醫藥行業一直以來都是個相對封閉的行業。復雜且與其他行業不共通的藥學知識,讓醫藥行業與外界之間始終隔著一道墻。如今這堵墻正在因為數字化技術的介入逐漸瓦解。越來越多人工智能企業,開始與藥物研發者們合作,將人工智能技術應用于新藥研發的各個環節中,加速新藥研發流程。
人工智能技術將如何改變新藥研發行業?誰已經走到行業頭部,誰又給出了全新的解決方案?
動脈網近期策劃“AI新藥研發”系列專題,厘清AI新藥研發的行業格局與發展脈絡,試圖解碼產業未來的發展方向。
近期,AI+新藥市場頻頻傳來捷報,多家企業在2020年完成了高額融資。
2020年9月,AI驅動藥物研發公司晶泰科技宣布超額完成3.188億美元C輪融資,創下全球AI藥物研發領域融資額的最高紀錄。同月,AI臨床階段藥物研發公司Recursion Pharmaceuticals也完成了2.39億美元D輪融資。將時間再往前推進一個月,2020年8月,又一AI驅動藥物研發公司星藥科技宣布完成1000萬美元PreA輪融資。
醫藥研發是制藥企業價值和生命力的核心所在,但新藥研發周期長、成功率低和研發費用高一直是該領域內的三大困境。以深度學習為代表的人工智能技術,憑借其強大的發現關系能力和計算能力加速醫藥研發,掀起了AI+新藥的熱潮,不僅誕生了眾多AI+新藥企業,還有促進了傳統制藥巨頭在AI+新藥領域的探索。
2020年6月,Drug Discovery Today期刊發表了一篇短文綜述《The upside of being a digital pharma player》,文章分析了2014年到2018年,全球21家制藥巨頭研發部門中AI應用的現狀。結果表明,AI+新藥領域盡管仍處于早期,但已經趨于成熟。該文章分析了各大制藥巨頭的收益和研究投入,發現僅賽諾菲和吉利德兩家企業的投入大于收益,阿斯利康和諾華兩家企業則是收益遠遠大于研究投入的代表。
動脈網據公開資料統計,截止到2020年10月16日,海內外共有56家AI+新藥企業共獲得融資,累計獲得融資總額共計45.81億美元。其中,國外有37家公司獲得融資,累計總額共計31.65美元,國內有19家公司獲得融資,累計融資總額14.16億美元。
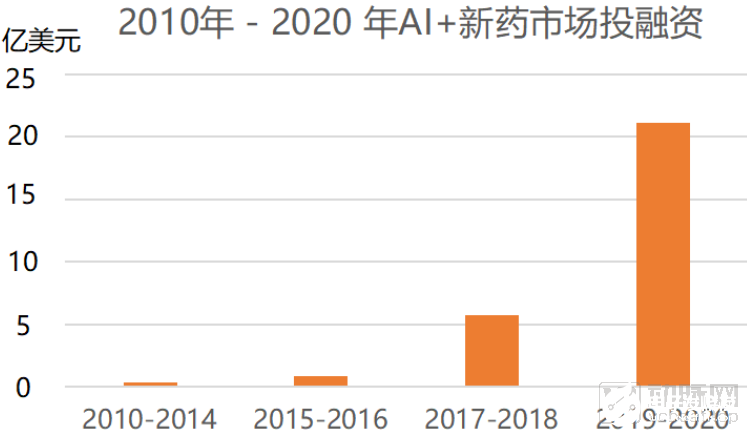
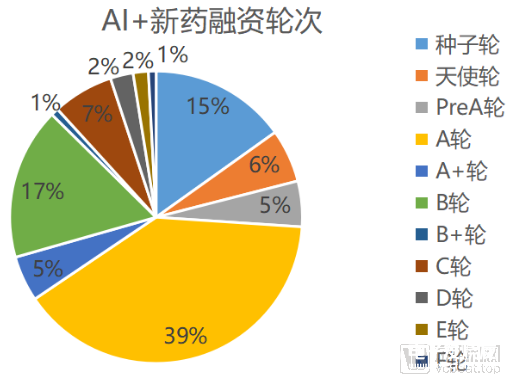
AI+新藥研發市場從2010年到2020年,獲得融資金額逐年上升,二級市場活躍,動脈網對56家AI+新藥研發企業進行梳理發現,目前僅有三家企業(BioXcel Therapeutics、IQVIA、Schrodinger)上市,AI+新藥研發目前正處于成熟的起步階段。
AI將為藥企帶來怎樣的突破?AI+新藥研發的應用場景發展現狀如何?頭部企業為何受到資本青睞?
AI突破新藥研發困境,數字化醫藥時代已經到來
隨著世界各國經濟的發展以及人民生活水平的提高,全球醫療支出不斷增加,制藥工業的發展得到了極大地提升,醫藥行業市場規模日益擴大。
2017年全球醫藥市場銷售額已經突破12000億美元,預計到2021年銷售總額可達到14750億美元,2012~2021年的年均復合增長率為4.9%。
而同時期中國醫藥市場的銷售額將從2012年的770億美元增長到2021年的1780億美元,年均復合增長率達到9.8%,是全球醫藥市場的2倍。這表明全球醫藥市場在穩步增長,而中國醫藥市場的增長更快,具備更好的發展潛力。
中國的醫藥市場位于世界第二大市場,在市場驅動力的高速增長下,我國醫藥市場在過去幾年保持著超過全球醫藥市場的增速增長。數據顯示,2019年中國醫藥市場規模為16330億元,預計2020年將進一步擴大至17147億元。醫藥市場穩步增長,藥企更加需要加大新藥研發力度來滿足市場的需求。
新藥研發主要包括藥物發現、臨床前研究、臨床研究以及審批與上市四個階段。
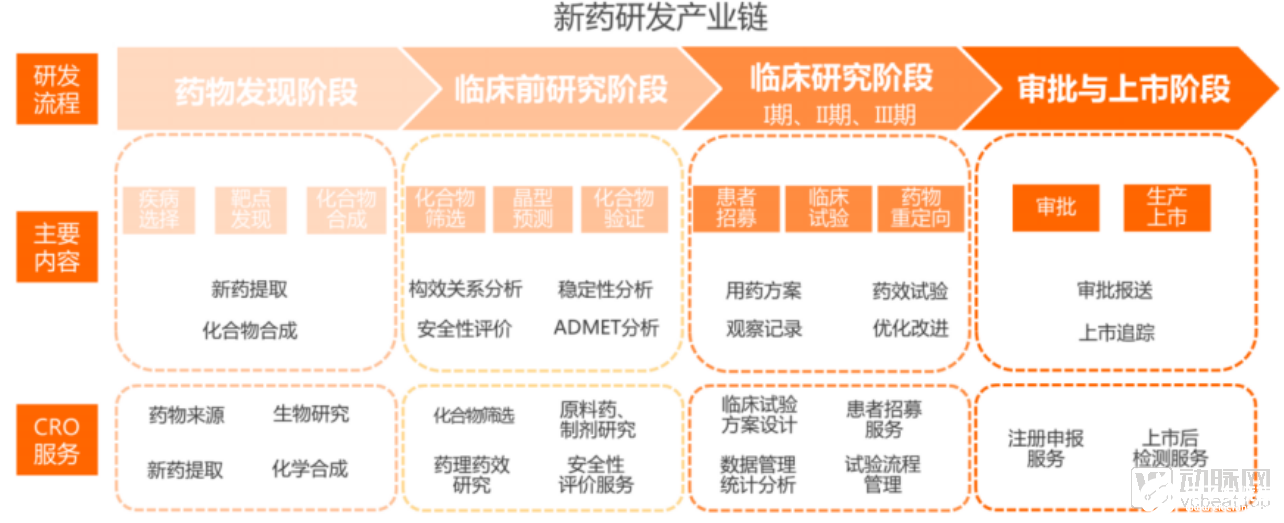
其中,藥物發現階段主要涉及疾病選擇、靶點發現和化合物合成。而臨床前研究階段則以化合物篩選、晶型預測、化合物驗證為主,包括藥物的構效關系分析、穩定性分析、安全性評價和ADMET分析等。
藥物發現階段和臨床前研究階段是藥企亟待攻關的兩大難點,新藥研發面臨研發周期長、研發成功率低以及研發費用高等三大困境。
藥物研發,越往后成本越高,但如毒性、溶解度等對藥物成敗起關鍵作用的性質要在相對后期才能進行實驗研究。因此,傳統方法,往往在投入了大量的時間、人力、金錢成本進行研發推進后才發現一個藥物候選并不適合成藥,這就造成很多資源和機會上的浪費。
各大傳統藥企在面臨研發周期長、研發成功率低以及研發費用高的困境下,都在努力嘗試通過技術創新來加快新藥研發速度、提高成功率和降低成本,以能更好地滿足日益增長的用藥需求。這為AI技術在新藥研發領域的應用帶來了契機。
AI主要應用其強大的發現關系能力和計算能力助力新藥研發。
在發現關系方面,AI具備自然語言處理、圖像識別、機器學習和深度學習能力,可以快速發現藥物和疾病、基因之間的鏈接關系。
在計算方面,AI具備的強大認知計算能力,可以對候選化合物進行虛擬篩選,更快的篩選出具有較高活性的化合物,為后期臨床試驗做準備。
AI+新藥應用場景:靶點發現先行,化合物篩選緊跟其后
機器學習的算法可以被大致分為兩類:監督學習和非監督學習。其中監督學習方法主要用于建立訓練模型,借助數據回歸分析方法和分類器方法,對數據類別或連續變量進行結果預測。而非監督學習則是用于建立一個開發模型,對含有相同特性的靜態數據進行聚類。
將這兩種方法應用到新藥研發中,非監督學習主要針對的是將海量醫學臨床前和臨床數據進行分類,例如單細胞RNA數據進行細胞類型和生物標志物分類、對生物標志物進行更深層次特征的篩選、低劑量CT數據分析等。
和非監督學習相比,監督學習方法算法更多,應用范圍更加廣泛。
分類器方法可以從海量文獻中挖掘靶點-疾病-基因關系,從基因表達特征中尋找組織特異性的生物標志物。回歸分析方法可以量化分析分子的構效關系,預測成功臨床試驗的基因表達特征和藥物敏感性等。在監督學習方法里,將數據回歸分析方法和分類器方法進行結合,可以進行虛擬的藥物靶標篩查實驗,從而輸出待測化合物的生物活性和檢測結果。
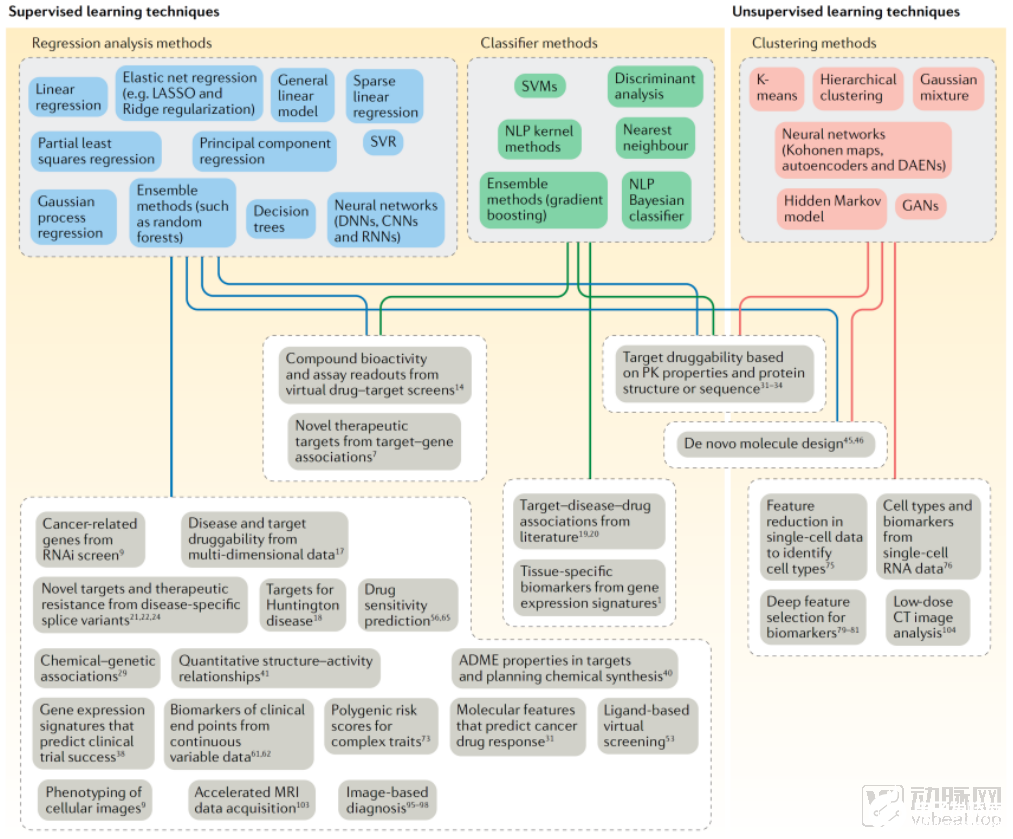
監督學習和非監督學習算法總結及其應用,來源:Nature Review Drug Discovery
此前蛋殼研究院據公開資料整理,將AI在新藥研發領域的主要應用分為以下七大場景:靶點發現、化合物合成、化合物篩選、晶型預測、患者招募、優化臨床試驗設計和藥物重定向。
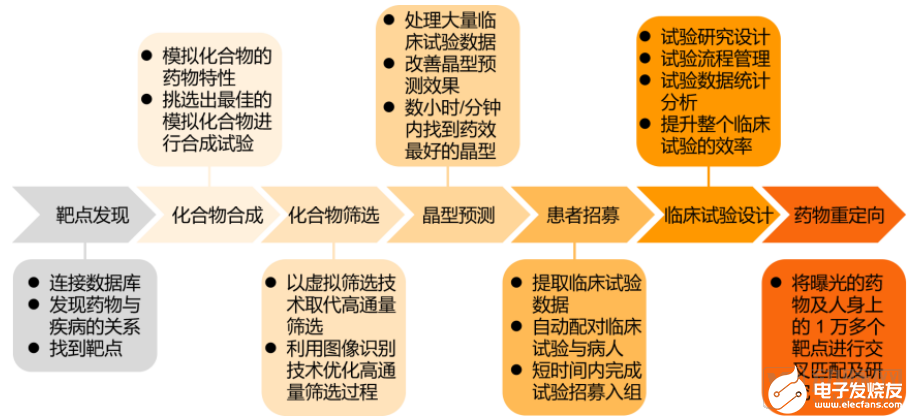
AI+新藥應用七大場景
非監督學習在健康數據的聚類上有突出優勢,更加貼近患者招募和優化臨床試驗設計等應用場景,但其目前的算法種類僅存在五種,與監督學習相比還有很大的進步空間。監督學習覆蓋了靶點發現、化合物篩選、藥物重定向等AI+新藥應用場景,這也是為什么目前以靶點發現和化合物篩選為重點的AI+新藥應用發展最快,并且在多家頭部企業開展業務中均有體現。
動脈網將截止到2020年10月9日的AI+新藥企業投融資事件進行分析發現,目前海內外融資總額排名前十的AI+新藥企業在七大應用場景有自己涉獵的重點,其中化合物篩選是眾多公司的優先選擇,7家頭部企業均開設相關研發管線。緊跟其后的則是靶點發現,共有6家企業有突破性進展。臨床試驗設計僅有一家TOP10企業開展相關業務。
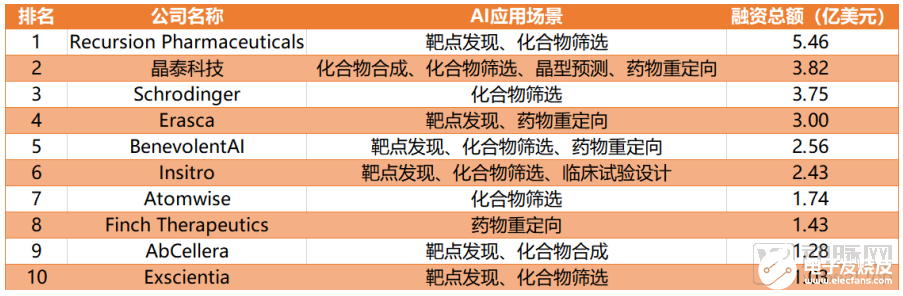
AI+新藥研發企業融資總額TOP10
1
靶點發現
新藥發現中基于藥物靶點的藥效學評價已經成為當今國內外新藥研究和開發的基本方針。當藥物靶點確定之后,就要開展基于靶點的藥效學評價,從而發現新藥。傳統的靶點研究依賴藥學研究工作者對相關科研文獻和個人知識經驗積累去推測靶點,平均耗時在2~3年的時間,并且發現靶點的成功率極低。
藥物靶點的發現核心是要從海量數據庫中獲得靶點和疾病之間的因果關系,機器學習可以提供一系列工具,通過使用大量的高質量生物數據和算法對計算機進行訓練,使計算機能夠學習如何執行任務,對指定問題進行發現和決策,由此誕生了目前最活躍的AI+新藥研發應用場景。
生物學數據的不斷豐富為靶點發現研究創造了資源積累。現代生物學數據,包含了大批量人群中的人類遺傳信息、健康個體和患有特定疾病個體的轉錄組學信息、蛋白組學信息和代謝組學信息,以及大量的臨床影像資料。這些多維度的高質量數據集在適當的分析方法下進行重新的組合,產生具有有效統計的模型,這樣的模型就是靶點發現的核心所在,它可以對靶點識別作出預測,縮短靶點發現周期。
隨著機器學習算法的不斷發展和數據質量和范圍的提高,目前機器學習已經能夠從人類健康相關的圖像、文本、生物識別信息和其他來自可穿戴設備、試驗數據及高緯度的生物組學數據獲取目標內容,并進行分析整理。
2
化合物篩選
當靶點大分子確定后,可以找到大量潛在分子和該靶點產生相互作用,藥物研發的下一步就是對潛在藥物分子的安全性進行有效判斷,篩選得到低副作用的潛在藥物分子,從而進行后續臨床研究。
一種潛在的藥物分子需要經過數年才能完成開發階段和臨床階段試驗,而且大多數化合物往往在進入市場之前就已經失敗了。傳統的新藥研發,研究者利用高通量篩選從成千上萬的候選化合物中識別出高潛力化合物,會消耗大量的時間和資源,而當候選分子的作用靶點極少時,消耗又會進一步加大。
為了解決這一問題,許多研究人員選擇用虛擬篩查(Virtual Screening, VS)來輔助高通量篩查,通過更加快速和廉價的虛擬篩選方式,減少進入高通量篩選的先導化合物數量,從而大大提高高通量篩選的產率。
AI+新藥融資總額TOP10企業梳理
為更加直觀地體現頭部企業在AI+新藥研發相關環節的應用和業務,我們對這十家最受資本青睞的公司進行簡單的梳理,主要涉及企業的概況介紹、主要產品以及企業的融資情況。
Exscientia
Exscientia搭建了人工智能平臺進行自動化藥物研發指導,主要應用場景為靶點發現和化合物篩選。
Exscientia利用組合算法對根據已有的藥物研發數據自動設計出上百萬種與特定靶標相關的小分子化合物(包括針對單靶點的小分子藥物以及針對靶點組合的雙特異性小分子藥物),并根據藥效、選擇性、ADME(機體對外源化學物的吸收)等其他條件對化合物進行評估和篩選。而后篩選出來的化合物會被合成并且進行實驗檢測,然后實驗數據會被反饋到AI系統中用于改善下一輪化合物的選擇。Exscientia組合算法的優勢可將藥物研發時間從4.5年降低至1年,并且能夠有效減少前期需要考慮的化合物數量。
Exscientia與制藥巨頭賽諾菲和住友制藥展開合作,分別研發出兩款雙特異性小分子,充分驗證了CENTAUR BIOLOGIST策略的可行性。截止到目前,Exscientia完成融資總額達1.03億美元。
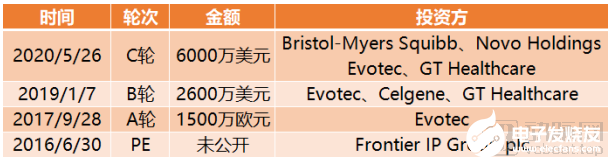
Exscientia融資
AbCellera
AbCellera是一家AI驅動的抗體研發公司,主要應用場景為靶點發現和化合物篩選。
公司擁有獨家藥物發現平臺,該平臺可以搜索和分析天然免疫系統,從而找到可用于預防和治療疾病的抗體。AbCellera將高通量微流控、機器視圖和人工智能相結合,從并行運算的高通量單個細胞分析中發現新的抗體分子療法,加快抗體藥物研發。
AbCellera的核心技術是高通量微流控平臺,該平臺通過使用微型化分析來自任何物種的單個B細胞,從而篩選出候選抗體藥物。該平臺可以根據疾病類型和應用目標進行個性化定制,在篩選出來的備選抗體中還可以進一步進行結構優化和來源優化。AbCellera的平臺可以篩選一次運動中的數百萬個細胞,誕生數百種治療候藥物。

AbCellera抗體篩選流程,來源:AbCellera官網
AbCellera利用其人工智能技術平臺,借助真實世界研究的優勢,僅在對患者血液樣本進行第一次篩查的3個月之后,就幫助全球第一個COVID-19抗體候選藥物成功進入人體臨床試。AbCellera已經建立了一個完整的技術站來搜索、解碼和分析天然免疫系統,找到最好的候選抗體并將其發展成藥。
截止到目前,AbCellera完成融資總額達1.28億美元。
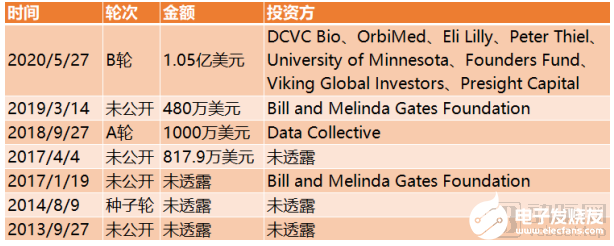
AbCellera融資歷程
Finch Therapeutics
Finch Therapeutics成立于2004年,是一家AI驅動的微生物療法研發公司,主要應用場景為藥物重定向。
公司采用創新的機器學習算法,基于高通量微生物分子數據,反向分析推導構建成功的臨床微生物療法,這類創新療法是以糞便移植科學為基礎的。Finch使用這種以人體為先的微生物學方法,來鑒定和開發具有臨床收益的菌株,并將這些微生物群落輸入給患者。
HUMAN-FIRST DISCOVERY?是Finch的核心平臺,利用人類小型生物群移植臨床研究數據和機器學習平臺,找到成功應用在患者疾病治療的微生物群體。Finch目前開設兩大研發管線,Full-Spectrum Microbiota和Rationally-Selected Microbiota,分別應對廣譜性和特異性的微生物療法。
Full-Spectrum Microbiota將健康捐贈者群體按照規則進行嚴格篩選,將捐贈者體內具備多樣性的微生物群體篩選并收集,以GMP標準制成藥物,保護了微生物群體的完整性,使其維持微生物多樣性和功能。Rationally-Selected Microbiota為可在純培養基中生長繁殖的微生物菌群設計靶向機制,得到精選微生物菌株。
截止到目前,Finch Therapeutics完成融資總額達1.43億美元。
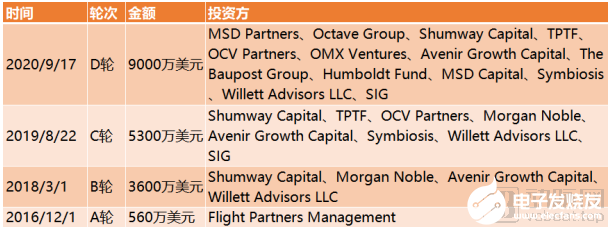
Finch Therapeutics融資歷程
Atomwise
Atomwise是一家利用超級計算機進行藥品研發的公司,主要應用場景為化合物篩選。
該公司旨在運用超級計算機、AI和復雜的算法模擬制藥過程,來預測新藥品的效果,降低研發成本。
Atomwise 公司開發的 AtomNet 化合物篩選系統,是一款基于卷積神經網絡的AI系統,旨在運用超級計算能力和復雜的算法,對潛在藥物分子的多向藥理學、選擇性和療效等性質進行篩選,同時保證其低脫靶效應。AtomNet可以自主地學習控制分子結合的特性,避免了傳統計算方法中典型的手工調整和參數化結合特性的過程。AtomNet將局部卷積濾波器應用于蛋白質結構目標信息,能夠成功預測目標的新活性分子。
AtomNet將對新藥的發現和優化從數年的時間縮短到數周,大大降低了時間和資源成本,為制藥公司、創業公司和研究機構帶來更多的發展機會。目前AtomNet已經將化合物發現效率提高1萬倍,篩選結果輸出速率比超高通量篩選高出100倍,每天可篩選超過1億個化合物分子。
截止到目前,Atomwise完成融資總額達1.74億美元。
Atomwise融資歷程,來源:動脈橙
Insitro
Insitro是一家以機器學習和高通量生物學為核心的藥物研發公司,主要應用場景為靶點發現、化合物篩選、臨床試驗設計。
Insitro不僅依靠有限的“已找到”數據,而且可以利用現代生物學工具來生成針對機器學習進行了優化的高質量大數據集,通過生成與患者數據一致的高通量功能基因組數據集,并通過新穎的機器學習方法來解釋這些數據,從而建立用于加速靶點篩選和推動治療方案設計的預測模型。
Insitro通過從遺傳、表型和臨床數據中獲取相關信息,利用機器算法來提高傳統遺傳分析的精準度,使之更接近疾病的基本結構和生物學,數據管道和自動化設施可以快速生成大量高質量的數據。同時,Insitro結合了來自患者的誘導多能干細胞(iPSCs)、基因組編輯、高含量細胞表型和機器學習等方式來構建體外疾病模型,通過優化遺傳、細胞類型、環境和多維數據收集,可以用更細的粒度區分細胞狀態,并預測與疾病相關的臨床特征,最大限度地預測藥物臨床結果。
Insitro疾病預測模型結合了體外細胞系統和計算機模擬機器學習,可以發現以前從未見過的疾病類型,并尋找其治療手段。通過預測模型,Insitro能夠識別疾病的突破性靶點,使藥物設計具有可行性,并推動生物標志物和臨床開發策略的發展。
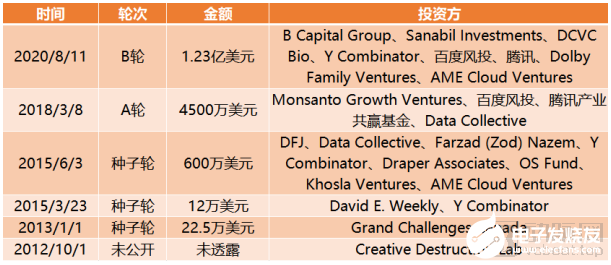
截止到目前,Insitro完成融資總額達2.43億美元。
Insitro融資歷程,來源:動脈橙
BenevolentAI
BenevolentAI是一家應用人工智能開發治療疑難疾病新藥公司,它是第一家完全集成的AI公司,同時擁有藥物發現和臨床開發能力,主要的應用場景是靶點發現、化合物篩選、藥物重定向。
BenevolentAI核心技術平臺為JACS(Judgment Augmented Cognition System),是一種判斷加強認知系統,從散亂無章的海量信息中提取出能夠推動藥物研發的知識,提出新的可以被驗證的假設,從而加速藥物研發的過程。
為提高JACS運算能力,公司從英偉達購買了專門為深度學習設計的超級計算機DGX-1。這臺計算機可以模擬發生在大腦皮層中的識別和學習模式,加快在不同信息源之間建立新的關系,從而產生更快、更多的新藥創新。
一種疾病在多個患者群中的致病機制是不同的,但有效的治療需要將這些不同的機制逐一擊破。公司的目標在于希望通過AI平臺來識別這些機制的藥物靶標,并讓藥物作用于它們。
BenevolentAI公司推出的JACS系統,憑借其自然語言處理能力和深度學習能力,在短時間內能夠集中處理大量的非結構化數據,包括疾病數據、藥物數據、試驗數據等等,并發現他們之間的新聯系,找到藥物的新適應癥,實現藥物重定向,幫助科學家發現藥物更有價值的適應癥。
2014年6月,BenevolentAI宣布與一家美國的制藥公司達成合作,并將兩款經過新適應癥(阿爾茨海默氏癥)驗證的新藥賣給這家美國公司,這兩款藥物處于中標候選化合物評估階段,此次交易高達8億美。2017年5月,BenevolentAI對一款名為bavisant的臨床試驗失敗藥物進行重定向分析,發現其對帕金森患者日間過渡嗜睡癥狀具有較好的治療效果。
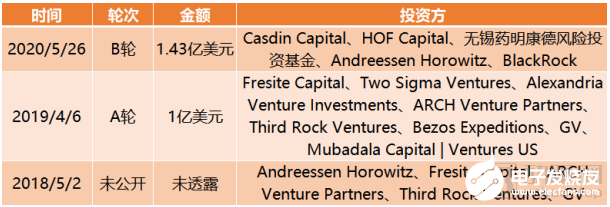
截止到目前,BenevolentAI 完成融資總額達2.56億美元。
BenevolentAI融資歷程
Erasca
Erasca公司成立于2018年,是一家專注于消除癌癥的生物技術公司,主要應用場景為靶點發現和藥物重定向。
Erasca有多個發現項目正在進行中,針對的是未公開的靶點,這些靶點是癌癥的生物學驅動因素。
OPRA(Oncology Pattern Recognition Algorithm)是Erasca的專有人工智能藥物發現平臺,利用機器學習等先進的計算工具,開發創新的腫瘤治療策略。該平臺不依賴于某種特定的藥物或任何關于癌癥治療的單一方法,以單劑聯合方法關閉癌癥通路,從而加速藥物發現。OPRA通過分析國內外大規模數據集,使Erasca的科學家能在龐大的癌癥生物學數據中處理基本致癌基因。
OPRA的數據醫療方法非常靈活,支持多個程序并行部署。OPRA還運用Erasca的藥物發現流程,使科學家和人工智能在研發過程中加速開發具有最大效力的療法,以實現其治愈癌癥的最終目標。
截止到目前,Erasca完成融資總額達3.00億美元。
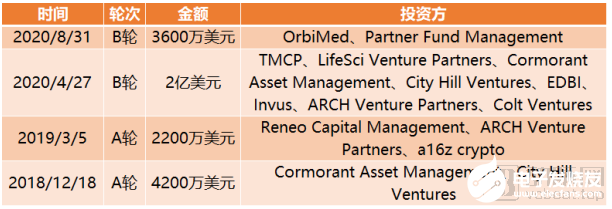
Erasca融資歷程
Schrodinger
薛定諤公司是一家藥物發現與材料設計公司,致力于開發和應用先進的計算方法,改變科學家設計治療方法和材料的方式,主要應用場景為化合物篩選。
FEP是薛定諤推出的藥物研發解決方案,它以“自由能擾動”方法為基礎,持續高精度地評估所有環節的物理作用對藥物分子與蛋白質結合的貢獻。其中,自由能擾動是指將一個初始分子擾動或轉化為另一個目標分子,通過評估自由能擾動帶來的結合親和力變動,確定分子的蛋白質結合親合力。
在FEP+中,薛定諤公司在GPU上運行具有計算效率的分子動力學引擎,并整合經典分子力學力場、自動化工作流程,采用高效,增強的采樣方法,實現自動原子映射和交互映射分配,以確保自由能量擾動評估的準確性。
利用其計算平臺,它每周都可以評估數十億種化合物分子。而利用常規的方法,普通的醫藥公司每年大約能在藥物發現項目中合成1000個候選化合物。
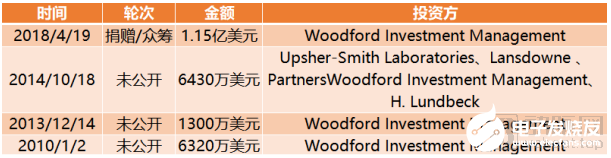
截止到目前,薛定諤完成融資總額達3.75億美元。薛定諤也是融資總額排名前十內唯一一家上市公司,上市當日募資逾2億美元,超過預期募資33%。
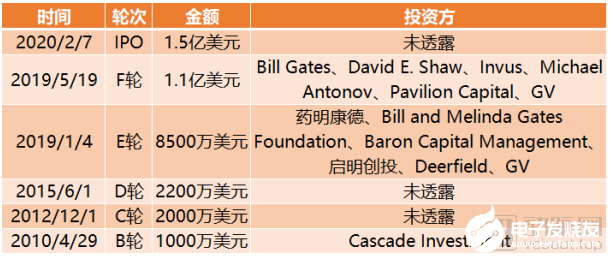
Schrodinger融資歷程
晶泰科技
晶泰科技成立于2015年09月11日,是一家以計算驅動創新的藥物研發公司,主要應用場景是化合物合成、化合物篩選、晶型預測及藥物重定向。
公司以計算驅動創新,其ID4(Intelligent Digital Drug Discovery and Development)智能藥物研發平臺結合量子物理、人工智能與超大規模云計算技術,可以準確預測小分子藥物的多種重要特性,加速藥物臨床前研究的效率與成功率。
晶泰科技突破性地實現對小分子藥物重要特性的快速、準確預測,藥物晶型預測技術已達到世界領先水平,在體系復雜度、預測精確度與計算速度上遠超同類預測方法。在藥物設計和藥物固相篩選等領域擁有多項行業領先的技術,目前,藥物晶型預測技術已被全球多家藥企采用,獲得業界專家的廣泛認可。
截止到目前,晶泰科技完成融資總額達3.82億美元。
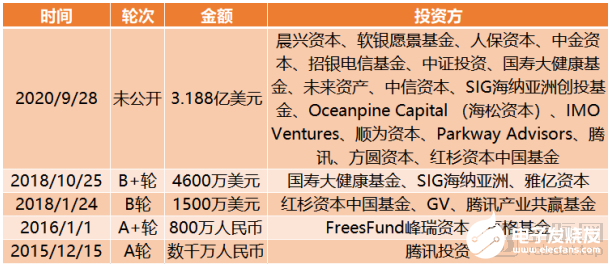
晶泰科技融資歷程
Recursion Pharmaceuticals
Recursion Pharmaceuticals是一家是一家集人工智能、實驗生物學和自動化于一體的臨床階段生物技術公司,主要應用場景為靶點發現、化合物篩選、臨床試驗設計。
Recursion將實驗生物學和自動化與人工智能結合在一個大規模并行系統中,有效地發現各種適應癥的潛在藥物,包括遺傳病、炎癥、免疫學和傳染病等疾病。
Recursion的機器人平臺擁有豐富的、可關聯的數據庫,其中包含超過2PB的生物圖像,這使得該公司的機器學習方法能夠揭示候選藥物作用機制和潛在的毒性,解碼生物學,并推進新的療法,從根本上改善人們的生活。
雖然Recursion計劃優先發展其自身的罕見疾病治療業務,但它將繼續在多個疾病領域,包括免疫腫瘤學、腫瘤學、衰老和炎癥等,與業界領先的制藥公司建立合作關系。
截止到目前,Recursion Pharmaceuticals完成融資總額達5.46億美元,是目前獲得融資總額最高的AI+新藥公司。
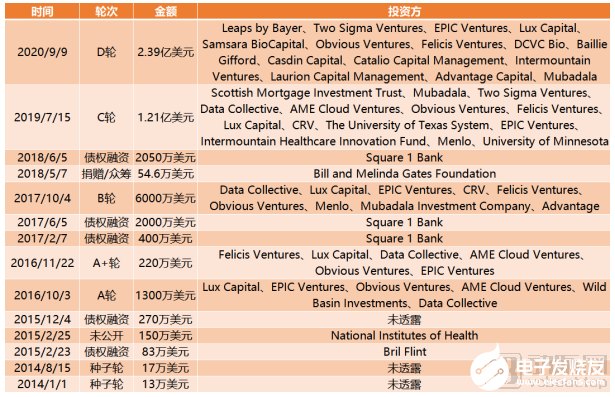
Recursion Pharmaceuticals融資歷程
責任編輯:PSY
-
AI
+關注
關注
87文章
30896瀏覽量
269111 -
人工智能
+關注
關注
1791文章
47279瀏覽量
238513 -
融資
+關注
關注
0文章
171瀏覽量
21297
發布評論請先 登錄
相關推薦




 AI+新藥領域融資總額已超45億美元
AI+新藥領域融資總額已超45億美元










評論