文章詳細闡述了這幾類常見的鋰電池體系正極材料的工作原理,對不同電池體系正極材料的優勢以及存在的問題進行了分析和歸納,有助于對鋰電池正極材料有一個較為全面的了解。
在眾多的電池體系中,如圖1所示,最吸引人的當屬鋰電池,包括傳統的鋰離子電池、新型的鋰空氣電池和鋰硫電池。目前鋰電池中正極材料的實際容量普遍偏低,成為研究的重點和難點。對于目前常見的鋰電池正極材料的結構及工作原理的認識,有助于我們理解和把握鋰電池中的核心問題和鋰電池的發展動態 。
圖 1 不同類型電池的質量能量密度與體積能量密度分布圖 一、鋰離子電池正極材料
鋰離子電池是通過鋰離子在正極和負極材料之間來回嵌入和脫嵌,實現化學能和電能相互轉化的裝置,又被形象的描述為搖椅電池,最早由A.Armand在1980年提出來,其結構及充放電原理如圖2所示 。鋰離子電池正極候選材料按結構主要可分為以下三類:(1)層狀結構的LiMxO2(M=Co、Ni、Mn)正極材料;(2)尖晶石結構的LiMn2O4正極材料;(3)橄欖石結構的LiFePO4正極材料。
圖 2 鋰離子電池的基本結構 1 層狀LiMO2(M=Co、Ni、Mn)正極材料
層狀結構的LiMO2 (M=Co、Ni、Mn)正極材料是在層狀LiCoO2材料的基礎上發展起來的,通過用Ni、Mn金屬來取代部分Co實現的,其結構層狀LiCoO2類似。如圖3所示,Li則位于正八面體平板之間,呈現出層狀排列。因此充放電過程中,鋰離子可以從其所在的平面上發生二維的移動,鋰離子的嵌入和脫嵌速度較快。
圖 3LiMO2晶體結構球棍模型示意圖 電化學過程如式1所示 :
層狀結構的LiMO2(M=Co、Ni、Mn)中,不同的過渡金屬材料在合成和電化學性質上還是稍有區別,總結如下: (1)層狀LiCoO2結構中,鋰離子的可逆嵌入脫嵌量只有0.5個單元,多于0.5時,材料會發生不可逆的相變,造成容量衰減。所以LiCoO2的耐過充能力差,Li1-xCoO2中x的范圍為0≤x≤0.5,理論容量只有156mAh/g。此外,處于充電狀態的Li1-xCoO2 (x>0)在高溫下容易發生如式2所示的析氧反應,放出氧氣。
(2)層狀LiNiO2的理論容量有275mAh/g,實際容量在190-200mAh/g。但由于鎳離子的離子半徑小于鋰離子,在充放電過程中鎳離子容易占據鋰離子的位置,出現陽離子錯排的現象,導致LiNiO2局部層間結構坍塌,造成材料的容量降低。此外LiNiO2材料還存在熱穩定性差、放熱量大、耐過充能力差等多種問題 。 (3)層狀LiMnO2與層狀的LiCoO2結構略有不同,氧原子是以扭變的四方密堆方式排布,呈層狀巖鹽結構。理論容量為285mAh/g,但其循環性能較差。材料在脫鋰后結構不穩定,會慢慢向尖晶石型LiMn2O4結構轉變,此時鋰離子會進入錳離子層,造成容量衰減 。此外錳離子還容易與電解液發生副反應,進而溶解在電解液里。高溫時材料還 易發生如式3的反應,產生雜相。
(4)LiNi1-x-yCoxMnyO2三元正極材料。在三元材料中最為典型的要屬鎳鉆錳比例為 1:1:1的化合物,其理論容量為277mAh/g。三元材料可通過調控Ni、Co、Mn的比例來調節材料的性能,但材料的穩定性和安全性問題還是存在,并且多種元素混合還帶來了合成工藝的困難 。 2 尖晶石結構LiMn2O4正極材料
早在1983年M.Thackeray和 J.Goodenough等人發現了錳尖晶石可作為鋰離子電池正極材料,理論容量為148mAh/g。尖晶石LiMn2O4結構中氧以立方密堆方式排列組成其晶胞骨架,其中Li+占據1/8的氧四面體8a位置,Mn原子占據1/2氧八面體16d位置。結構中錳有兩種價態,分別為Mn3+和Mn4+,各占50%,材料結構如圖4所示。
圖 4 LiMn2O4晶體結構示意圖
LiMn2O4結構中,空的氧四面體和氧八面體以共面、共邊方式連接,這些空位構成了三維的鋰離子擴散通道,因而材料的導鋰性很好。其電極反應如式4所示。當發生鋰離子嵌入和脫嵌時,結構中錳原子能穩定立方密堆的氧,支撐起整個結構,所以尖晶石 LiMn2O4材料結構相對穩定。
尖晶石LiMn2O4材料的最主要問題是其容量衰減過快,造成其容量衰減的原因主要有 :
(1)LiMn2O4在深度放電或者大功率充放電時,會轉化為四方相的Li2Mn2O4,材料中Mn被還原為三價。這種價態變化會導致Jahn-Teller效應引起材料的變形,引起晶胞體積增加6.5%,破壞材料晶體結構,引起容量衰減。 (2) 在反應過程中,Mn3+會發生歧化生成Mn4+和Mn2+, 二價錳離子會溶解到電解液中,造成活性物質流失。 3 橄欖石結構LiFePO4正極材料1997年JohnB.Goodenough報道橄欖石結構的磷酸鐵鋰也可作為鋰離子電池正極材料,LiFePO4的理論容量為170mAh/g。橄欖石結構的LiFePO4屬于正交晶系,其結構如圖5所示。
圖 5 LiFePO4晶體結構示意圖
氧原子以輕微扭曲的六方密堆方式構成晶胞的基本骨架,FeO6八面體靠頂點共用氧原子相連。LiO6八面體則靠共邊相連形成鏈狀,每個PO4四面體分別與一個FeO6八面體 和兩個LiO6八面體共邊。所有的氧離子都與五價的磷原子通過共價鍵結合,由于P-O鍵作用力強,P起到了穩定整個骨架的作用,材料的熱穩定性非常好,耐過充能力強。其電極反應如式5所示。
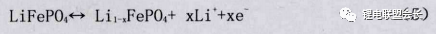
但在實際應用中,LiFePO4材料的容量和倍率性要比理論值低許多,這主要是因為材料的導電性和導鋰性不佳。計算結果表明在橄欖石型LiFePO4結構中,鋰離子從 a、b軸方向的的擴散勢壘過高 ,從而只能沿擴散勢壘較低的c軸方向擴散。因而LiFePO4材料中,鋰離子的擴散通道是一維的,鋰離子只能沿c軸方向 (對應于晶體的[010] 方向)擴散。
除此之外,由于FeO6八面體之間只是通過共頂點連接,并沒有共邊,所以沒有形成連續的網狀結構,導致材料的電子導電率較低 。 二、新一代高容量鋰電池正極材料當下鋰電池的研究熱主要是圍繞鋰空氣電池和鋰硫電池展開的,二者被認為是最具發展潛力的新一代鋰電池。它們與以往鋰離子電池正極材料在結構和反應機理上有很大區別。 1 鋰空氣電池鋰空氣電池是金屬空氣電池的一種,由于使用分子量最低的鋰金屬作為活性物質,其理論比能量非常高。不計算氧氣質量的話,為11140Wh/kg,實際上可利用的能量密度也可達1700Wh/kg, 遠高于其他電池體系。鋰空氣電池的基本結構和工作機理如圖6所示。
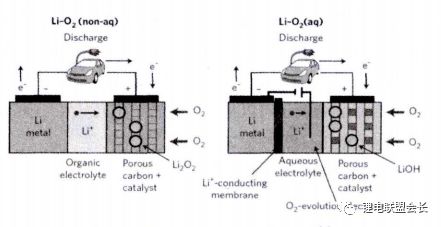
圖 6 鋰空氣電池結構示意圖
鋰空氣電池按使用的電解液的狀態不同,主要可分為水體系、有機體系、水-有機混合體系以及全固態鋰空氣電池。在有機體系鋰空氣電池工作時,原料O2通過多孔空氣電極進入電池內部,在電極表面被催化成O2-或O22-,接著與電解質中的Li+結合,生成過氧化鋰或氧化鋰,產物沉積在空氣電極表面。當空氣電極中的所有空氣孔道都被產物堵塞后電池放電終止。其電極反應如下所示:
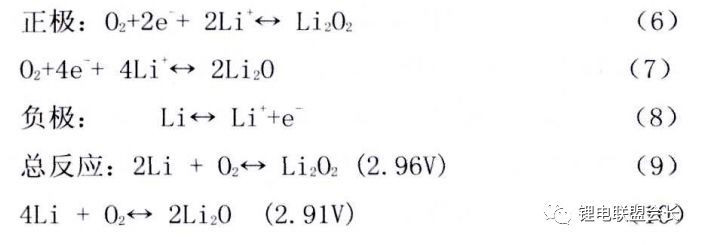
鋰空氣電池有著不可比擬的超高能量密度、環境友好以及價格低廉優勢,但其研究尚屬初級階段,存在非常多棘手的問題,主要有 :
(1)正極反應需要催化劑。放電過程中,在沒有催化劑存在的情況下,氧氣還原非常慢;充電過程中,電壓平臺為4V左右,容易造成電解液的分解等副反應 。需要使用適當的催化劑來幫助電池反應。
(2)鋰空氣電池是敞開體系 ,會引發諸如電解液揮發、電解液氧化、空氣中的水分和CO2與金屬鋰反應等一系列致命問題。
(3)空氣電極孔道堵塞問題 。放電生成不溶于電解液的過氧化鋰或氧化鋰會堆積在空氣電極中,阻塞空氣孔道,導致空氣電極失活、放電終止。 綜上所述 ,鋰空氣電池存在很多問題亟待解決:包括氧氣還原反應的催化 、空氣電極透氧疏水性、空氣電極失活等。雖然鋰空氣電池取得了一些進步,但要真正應用還有很長一段路要走。
2 鋰硫電池鋰硫電池最早起源于上世紀70年代,但是一直以來鋰硫電池的實際容量不高、衰減嚴重,并未受到重視。Linda F.Nazar題組報道了硫碳復合物作為鋰硫電池正極材料獲得較好的循環性和非常高的放電容量,掀起了鋰硫電池研究的熱潮。鋰硫電池主要使用單質硫或硫基化合物為電池正極材料,負極主要使用金屬鋰,其電池結構如圖7所示 。
圖 7 鋰硫電池結構示意圖
其中以正極材料為單質硫 (主要以S8環形態存在)計算,其理論比容量為1675mAh/g,理論放電電壓為2.287V,理論能量密度為2600Wh/kg。充放電時,電極反應如下所示:
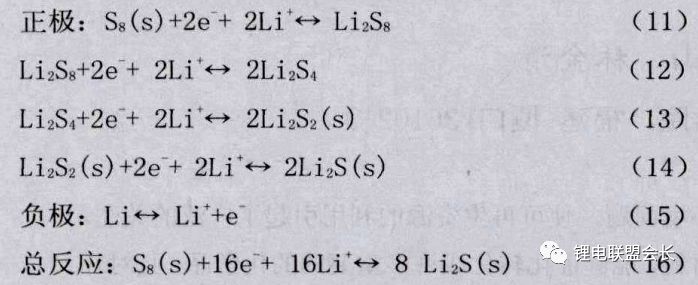
鋰硫電池中,正極材料的反應是一個多電子、多步驟的逐級反應,如圖8所示。以硫放電過程為例,簡單可以分為兩個階段,首先固態單質硫S8與Li+生成液態的Li2S8,隨著放電程度的深入會經過可溶性Li2S6最終生成可溶性Li2S4,對應電壓平臺2.4V-2.1V,此過程由于有液態物質的生成,反應速度較快。
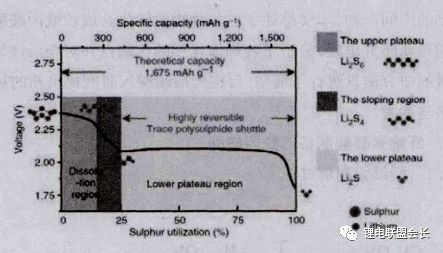
圖 8 鋰硫電池典型放電曲線示意圖 接著隨著進一步的放電,在2.1V電壓平臺處,可溶性Li2S4轉化成不溶性的固相Li2S2,最后再進一步生成終產物固相的Li2S,由于這一階段中固體開始生成,使得離子擴散變慢,所以反應速度較緩。不同于傳統的鋰離子電池材料,鋰硫電池充放電時單質硫和硫化鋰中間經過多硫化鋰Li2Sx(x=2-8)而并不是通過鋰離子在正極材料和負極材料之間的往返嵌入和脫嵌來實現充放電的,因此鋰硫電池性能受正極材料的鋰離子脫嵌能力影響小。
鋰硫電池的優勢非常明顯:具有非常高的理論容量;材料中沒有氧,不會發生析氧反應,因而安全性能好;硫資源豐富且單質硫價格極其低廉:對環境友好,毒性小。但鋰硫電池真正應用還面臨著一些問題,主要包括 : (1)導電性和導鋰性差:單質硫中硫分子是以8個S相連組成冠狀的S8,屬于典型的電子、離子絕緣體,其室溫下電導率僅為5×10-30 S/m。而且產物Li2S2和Li2S也都是電子絕緣體。因而活性物質的利用率不高、倍率性能不佳。目前主要通過制備小尺寸的硫碳復合材料來解決鋰硫電池正極材料的導電性和導鋰性問題。
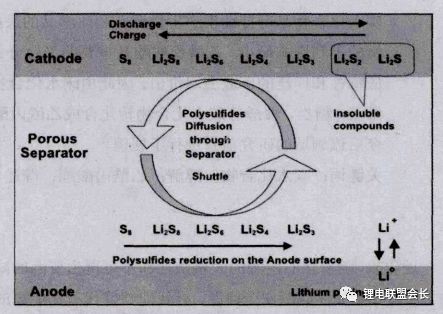
(2)多硫化鋰穿梭效應:在鋰硫電池充放電過程中,長鏈多硫化鋰Li2Sx(4
圖 9 多硫化鋰的穿梭效應示意圖 (3)體積膨脹問題:硫在完全充電轉化為硫化鋰時,體積膨脹達76%,容易引起正極材料的結構被破壞,影響活性物質的穩定性,造成容量衰減。 (4)金屬鋰負極:由于硫本身不含鋰原子,所以必須使用金屬鋰單質作為負極材料,但這樣一來就不可避免會產生鋰金屬的枝晶問題,帶來安全隱患。
責任編輯:xj
文章出處:【微信公眾號:鋰電聯盟會長】歡迎添加關注!文章轉載請注明出處。
盡管鋰硫電池還存在著一些問題,近些年隨著對鋰硫電池研究的深入,通過減小硫顆粒尺寸、對硫材料進行包覆、制備硫碳復合材料、對多硫化鋰吸附、改進電解液等多種措施,在提高硫材料的容量和循環性方面取得了重要進展。
參考:《鋰電池正極材料工作原理》
原文標題:鋰離子電池正極材料體系基礎,這篇文章看完就全明白了!
-
鋰離子電池
+關注
關注
85文章
3241瀏覽量
77722 -
正極材料
+關注
關注
4文章
322瀏覽量
18524
原文標題:鋰離子電池正極材料體系基礎,這篇文章看完就全明白了!
文章出處:【微信號:Recycle-Li-Battery,微信公眾號:鋰電聯盟會長】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
退役電動汽車鋰電池正極材料的直接再生策略—去除殘留污染物的關鍵作用




 幾類常見的鋰電池體系正極材料的工作原理
幾類常見的鋰電池體系正極材料的工作原理











評論