DNA分子間不是固定的——它們會不斷拆分和結合來形成新的形態。Davide Michieletto解釋了如何利用DNA這一特點來制造出新一代“拓撲活性”材料。
不是我不明白,這世界變化快!直到幾年前我都沒想過DNA還可以買賣。作為一個物理學家,我自詡熟知DNA——“生命分子”:它們攜帶的遺傳信息使得復雜的生命體,比如你和我,得以構建出來。但令我驚訝的是,現在的生物技術公司可以從病毒中提純DNA,然后將濃縮DNA溶液郵寄給你。事實上,你完全可以在網上訂購DNA,正如我現在做的。只不過讓我意想不到的事還在后面。
當DNA溶液送到我在愛丁堡的實驗室,它們裝在試管里,每毫升水中約有半毫克DNA。我急于用它們做實驗,但當我試圖用吸管取出部分溶液,它們卻并沒有順暢地流到塑料吸管中。相反,它們很粘稠,很難用吸管吸出。我立刻沖到實驗室同事面前,急切宣布我的驚人“發現”。他們卻像看傻瓜一樣看著我,仿佛在說DNA溶液當然是非常粘稠的。
我其實應該想到的。DNA雖然常被視作一種神奇的材料,可本質上它就是由4種不同的單體形成的長鏈雙螺旋聚合物:四種核苷酸單體A、T、G、C通過堿基配對原則堆疊在一起。就像其他高分子濃溶液一樣,DNA分子鏈會糾纏在一起。事實上它們團縮得非常厲害,在一個人類細胞里,長達 2 m 的DNA分子團縮成約 10 μm 大小。這就好像把 20 km 長的頭發絲放入手機大小的盒子里。
但如果DNA分子一直死纏著不放,那么大自然就會有大問題。比如染色體——包含數百萬堿基對的DNA長鏈——就很難被持續的讀取和復制。如果真是那樣,細胞就不能制造蛋白質,也不能繁殖了。好在進化自有奇跡,大自然能夠“設計”出某些特殊蛋白質以改變DNA的形狀(或“拓撲”),從而解除DNA間的糾纏,順利解決了這個難題。
如果不借助外物,一條典型的人類染色體要花500年左右的時間才能解開糾纏。但在某些特定蛋白質的幫助下,DNA分子可以通過暫時斷開而后又重新接起來大大加快解糾纏的過程。這些蛋白質對生物細胞的運作起著至關重要的作用——那也是為什么我從網上買的DNA那么粘稠:溶液里沒有蛋白質幫助它們完成解糾纏。
不幸的是,在某些癌細胞里卻有著過量的這類蛋白質。它們能非常有效地幫助DNA完成解糾纏,導致癌細胞以驚人的速度繁殖。事實上,一類非常有效的抗癌藥就是能夠抑制“拓撲異構酶Ⅱ”蛋白質的解糾纏功能。但此類藥也有不良的副作用,要知道拓撲異構酶蛋白質的解糾纏功能對正常細胞來說也是必不可少的。
但如果我說DNA改變自身結構的能力就有點兒像肥皂,你會相信嗎?將DNA和肥皂聯系起來確實有點令人吃驚。但將高分子物理和分子生物學的知識聯系起來,可以利用肥皂的特點來精巧地設計制作出拓撲結構隨時間而變的DNA柔性材料。通過微調它們的拓撲結構,我們就能夠以不同尋常的方式來控制材料的物理性質。
一個蟲子的故事
為了理解DNA和肥皂之間的關聯,需要指出的是肥皂和洗發劑都是由“雙親分子”組成的。雙親分子的一部分親水,而另一部分疏水。這些分子在水中不能單獨存在,而是形成更大的聚集體結構,被稱為“膠束”。當溶液濃度比較低時,雙親分子的聚集體通常呈球狀。但在高濃度時,這些分子聚集成長條形蠕蟲狀膠束,疏水部分被包在內側(圖1(a))。
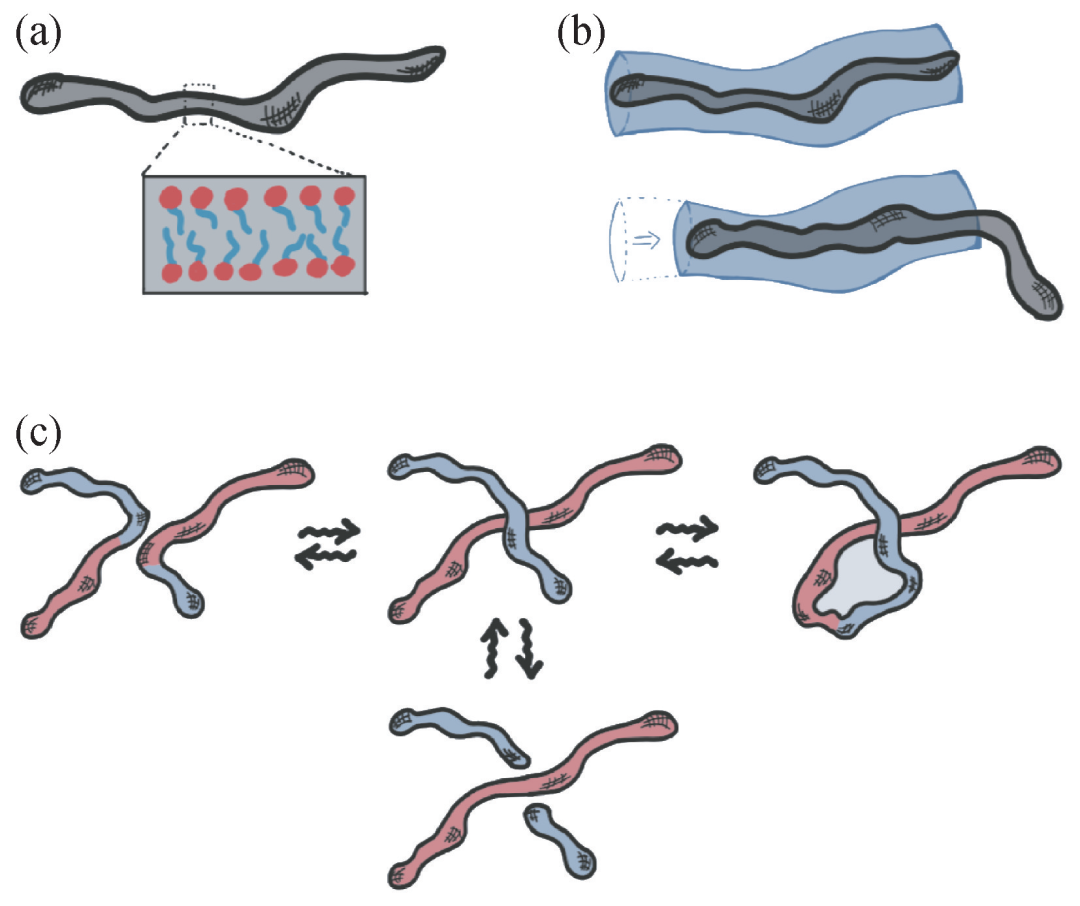
圖1 肥皂、洗發劑和蠕蟲型膠束。
(a)肥皂和洗發劑都由雙親分子組成,包含親水部分(紅色)和疏水部分(藍色)。這些雙親分子聚集成長管型的“蠕蟲狀膠束”。管間的糾纏使得這些物質顯示出黏性;
(b)這些蠕蟲狀膠束可以解糾纏,就像糾纏在一起的聚合物長鏈能夠通過滑移而分開。對聚合物而言,這一過程被模型化成分子在假想的管道中的滑移,就像蛇的爬行,而假想的管道體現了空間約束效應;
(c)蠕蟲狀的膠束可以通過重新連接(左圖)、斷裂(下圖)和融合(右圖)改變它們的結構。這些行為在主鏈上隨機發生,屬于熱平衡且可逆過程
從納米尺度到微米尺度,這些大小不等、細長的多分子聚集體在高濃度時顯現出奇怪的行為。特別是,對于DNA,它們糾纏在一起,增加了溶液內部的摩擦力,導致其很難改變形狀。但實際上,也正是蠕蟲狀膠束間的糾纏給肥皂、洗發液、臉霜或發膠帶來令人愉悅的、光滑的手感,給洗澡淋浴帶來舒適感。
正如聚合物一樣,這些蠕蟲狀膠束通過鏈的滑移可以解糾纏(圖1(b))。但它們也有其他的選擇。那是因為蠕蟲狀的膠束在不斷的變形:它們和周邊的鏈斷開、融合、又重新連接。最終,不會有兩個完全相同的膠束存在(圖1(c))。這種不斷變化的特點完美詮釋了希臘哲學家赫拉克利特“萬物皆流(panta rhei)”的思想(作為研究流動的科學,“流變學(rheology)”一詞即出于此)。實際上,膠束可以被看作為準活性物質,這得益于它們能夠改變自身的結構或拓撲性。
動態結構變化和傳統弛豫間的相互耦合導致了非同尋常的流動性質。比如在外加剪切力時,肥皂的黏度下降得非常快。實際上,這種黏度的突然降低正好解釋了為什么乳液、洗發劑以及乳膏能夠很容易從細小的管口被擠出,盡管它們本身還是具有非常大黏性的。
斷裂和重新連接
正如肥皂內的蠕蟲膠束一樣,DNA分子也總是經歷著鍵的斷裂和重新連接,從而整個分子鏈展現出新的拓撲結構(圖2)。但有一個顯著的不同:DNA需要保持基因序列,否則細胞就會病變或死亡。對于肥皂而言,膠束內的單體沒有特定的序列,因此它們可以以任何順序重新連接。而大自然要求蛋白質對DNA拓撲結構操控的同時需要將DNA的序列信息完好無損地保留下來。
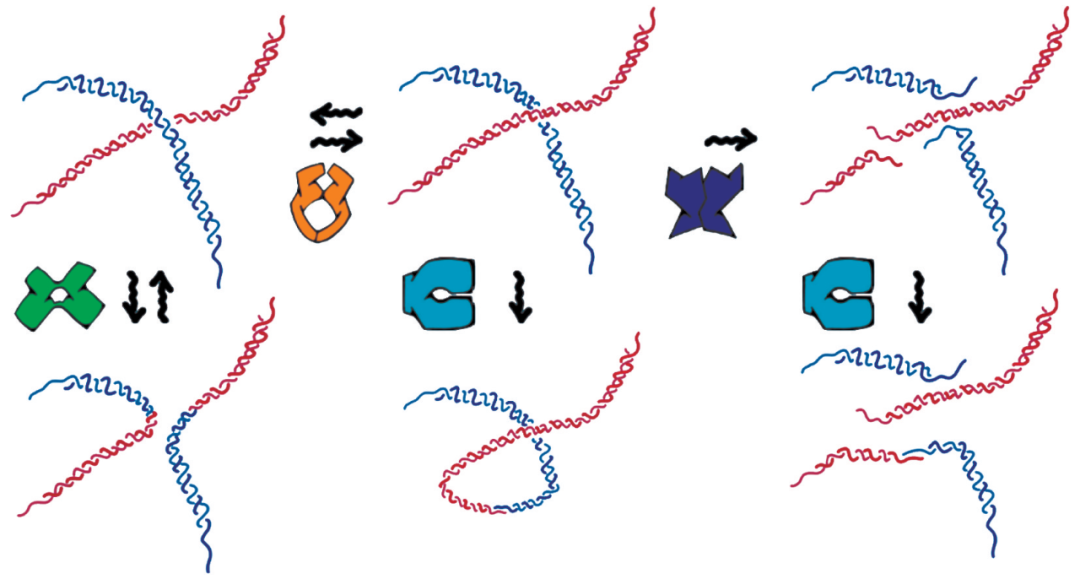
圖2 DNA中的拓撲形變。
正如肥皂中的蠕蟲狀膠束一樣,DNA 鏈也可以經歷各種的拓撲形變,盡管需要蛋白質的參與。這里展示了鏈的分離和重新連接(重組酶蛋白,綠色);分離和重新交叉(拓撲異構酶蛋白,黃 色);融合(連接酶蛋白,青色)和斷裂(限制內切酶,紫 色)等過程。前兩個過程對于相同的蛋白質是可逆的,其他過程不可逆
這對如何進行DNA拓撲結構的改變有著根本性的影響。不同于一般的蠕蟲狀膠束,它們可以隨時隨地進行拓撲結構的改變。DNA只能在對的位置和對的時間里發生拓撲結構的轉變(正如生物學家所言,它們必須受到“規范”)。隨之,一個令人興奮的想法在我腦中醞釀:在接下來的5年里,我將努力嘗試人工再現,創造出新一代材料。
比如說要斷開DNA,你就需要“限制性內切酶”,它能夠對某一特定序列的DNA進行切割。同時,拓撲異構酶蛋白質必須精確地定位到染色體的某些特定位置,那些位置上會聚集更多的糾纏態和機械應力。類似的,當兩段DNA重新連接重新結合時——例如,當父母的遺傳物質在配子(卵子和精子細胞前體)中重組時——這一過程在空間和時間上都受到嚴格的控制,避免細胞染色體畸變的發生。就像是DNA在蛋白質的調控下如同智能蠕蟲狀膠束一般。
說來也許你都不信,但事實就是美國微生物學家漢密爾頓·史密斯在20世紀70年代首次發現限制性內切酶時,他沒有采用任何花哨的生物技術,僅僅是進行了精確的黏度測量。從病毒中提取DNA,并將其混入到細菌內部,他觀察到DNA溶液的黏度隨時間降低;流動變快的溶液就意味著DNA在細菌內部被一種酶切斷了。史密斯因此獲得了1978年的諾貝爾生理學或醫學獎,而這都是基于一個簡單而極具物理洞察力的黏度測量實驗,想想就令人心生敬畏。
DNA和納米技術
絕對不止我一人看到DNA具有充當先進聚合物材料的潛力,而不僅僅是充當遺傳物質。在過去的20年里,研究者們已經開發了很多新的DNA材料,例如水凝膠和納米支架。這些材料能夠利用DNA特殊的信息編碼功能實現骨頭、器官、皮膚和細胞的再生長。最近,“DNA折紙”技術被發展起來,DNA鏈上的遺傳信息被存儲到DNA的三維結構中(圖3(a))。實際上,我們甚至可以看到DNA做成的納米機器人或納米機器了。
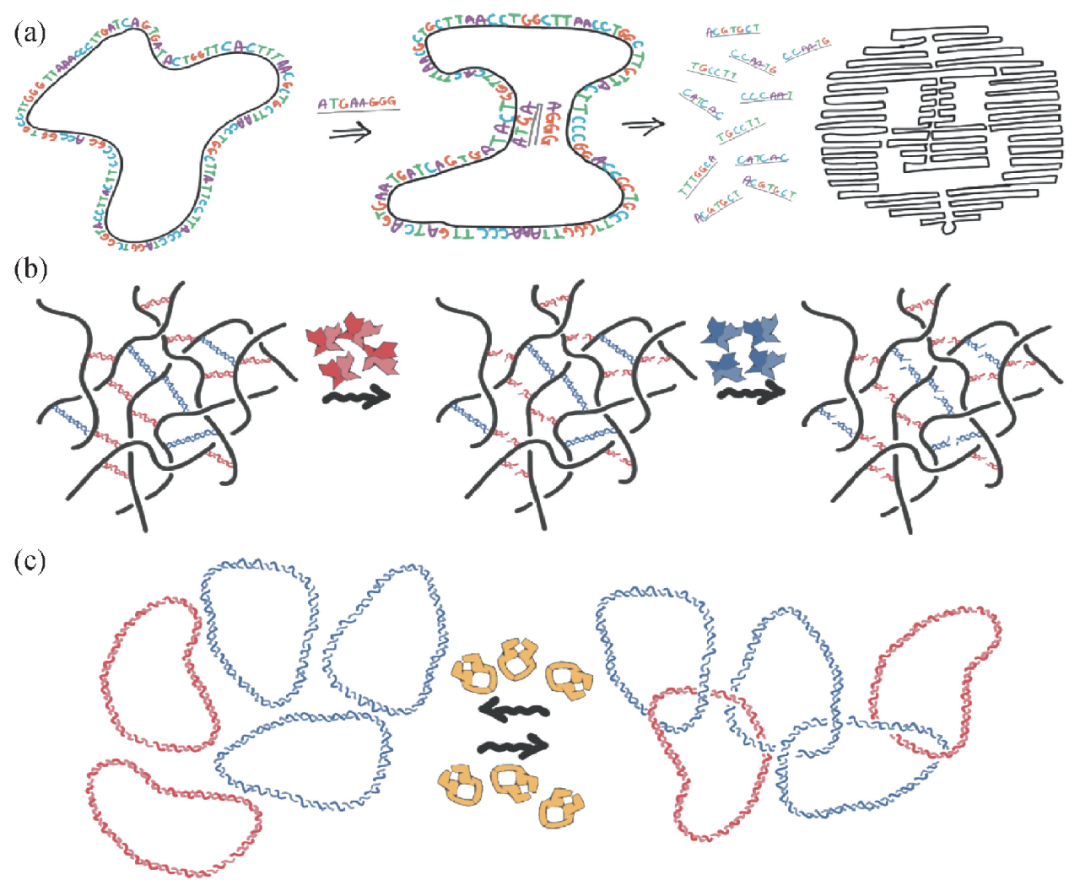
圖3 用 DNA 創造新結構。
(a)DNA折紙是指將單條DNA通過搭建“腳手架”的方式(左邊)折疊成復雜的二維或三維結構(如笑臉結構,右邊)的藝術。過程中會用到數百個“訂書針”,它們都是些短的DNA單鏈片段,能夠和DNA“腳手架”上的片段進行特定的配對(中間);(b)由DNA和限制性內切酶制成的智能響應型凝膠;(c)由環形DNA連接而成的“奧運凝膠”。可以通過DNA質粒(環形DNA)在拓撲異構酶作用下的自組裝來獲得
讓我對這一領域興奮不已的是,蛋白質可以及時改變DNA的拓撲結構,這就使得DNA溶液可以充當新型“拓撲活性”材料,響應外界刺激。這些溶液和納米材料會利用DNA的信息存儲能力形成復雜的3D結構或雜化支架結構,這些結構具有特殊蛋白賦予的響應性、可塑性和精確性(圖3(b))。例如,加入限制性內切酶能夠在特定的序列處將DNA切斷,這樣就可以在不再需要DNA支架的時候將其降解。這一點非常有用!當DNA支架被用來幫助患者體內骨頭再生時,一旦骨頭再生完成,DNA支架就可以被降解。
同時,將拓撲異構酶加入到一堆DNA質粒(環狀DNA)就能產生凝膠,環形DNA交聯成像奧運五環一樣的結構(圖3(c))。盡管在實驗室里經過了數十年的努力,也沒有合成這些“奧運凝膠”結構,但大自然在數百萬年前就能那么做了。
事實上,我驚奇地發現,一種名叫錐蟲的單細胞生物把它們的存在和奧運凝膠聯系了起來。特別是,它們的部分基因呈現的就是巨網絡結構。這些網絡結構里每一個DNA微環連接著周邊其他3個微環,形成的結構看起來就像是中世紀的鏈甲片。更令人著迷的是,這種拓撲結構可以進行不斷拆分,也可以由組成單元按照正確的方式來組裝形成。
尋根究底的跨學科研究
除了對科學本身的興趣之外,研究生物結構也幫助我們設計新一代自組裝拓撲材料。這些復雜的基于DNA的材料具有非常好的應用前景。不過為了取得更多的進展,我們需要跨學科的團隊,包括物理學家、化學家和生物學家的通力合作。更重要的是,他們的研究工作還尋根究底,去探索一些未知的基本規律,而不僅僅是試圖解決工業上遇到的某些特定技術問題。
這方面一個成功的事例就是,在英國創立了由物理學家湯姆?麥克利舍負責的“生命網絡的物理”,可看出這一領域的研究已經受到英國研究委員會的重視。盡管剛剛起步,我希望它將受到穩定的、長期的、多學科領域的支持。英國物理研究所的生物物理課題組創刊了“Physics World”,它也在鼓勵更多的課題組在軟物質和生物物理的交叉領域里加強多學科的合作方面發揮重要作用。
然而,我們仍然需要更多高質量刊物能夠意識到這類跨學科研究的重要性,跨越傳統學科界線的研究非常重要。這一個令人激動的領域,不管在哪里開展研究,它都會讓人們每天都能學到新的東西。我希望,在未來的10到20年里,科學工作者們在開始他們的職業生涯時,不再感到只能被迫在某一特定領域開展研究,或是只能選擇理論或實驗。相反地,無論他們的科研背景是什么,如果他們能夠做一些滿足自己科研好奇心的研究,那將是非常棒的!如果他們能夠那么做的話,誰又能想到接下來我們會發現什么呢?
編輯:jq
-
拓撲
+關注
關注
4文章
341瀏覽量
29646 -
納米
+關注
關注
2文章
699瀏覽量
37078 -
DNA
+關注
關注
0文章
243瀏覽量
31108
原文標題:沒有看錯,DNA都可以用來構建柔性材料了!
文章出處:【微信號:bdtdsj,微信公眾號:中科院半導體所】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦




 DNA也可以用來構建柔性材料?
DNA也可以用來構建柔性材料?










評論