在液態鋰離子電池首次充放電過程中,電極材料與電解液在固液相界面上發生反應,形成一層覆蓋于電極材料表面的鈍化層。這種鈍化層是一種界面層,具有固體電解質的特征,是電子絕緣體卻是Li+ 的優良導體,Li+ 可以經過該鈍化層自由地嵌入和脫出,因此這層鈍化膜被稱為“固體電解質界面膜”( solid electrolyte interface) ,簡稱SEI 膜。
正極確實也有層膜形成,只是現階段認為其對電池的影響要遠遠小于負極表面的SEI膜,因此本文著重討論負極表面的SEI膜(以下所出現SEI膜未加說明則均指在負極形成的)。負極材料石墨與電解液界面上通過界面反應能生成SEI膜 ,多種分析方法也證明SEI 膜確實存在 ,厚度約為100~120nm ,其組成主要有各種無機成分如Li2CO3 、LiF、Li2O、LiOH 等和各種有機成分如ROCO2Li 、ROLi 、(ROCO2Li) 2 等。
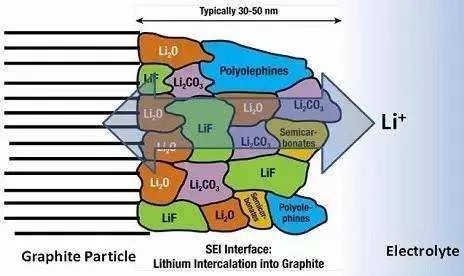
SEI 膜的形成對電極材料的性能產生至關重要的影響。一方面,SEI 膜的形成消耗了部分鋰離子,使得首次充放電不可逆容量增加,降低了電極材料的充放電效率;另一方面,SEI 膜具有有機溶劑不溶性,在有機電解質溶液中能穩定存在,并且溶劑分子不能通過該層鈍化膜,從而能有效防止溶劑分子的共嵌入,避免了因溶劑分子共嵌入對電極材料造成的破壞,因而大大提高了電極的循環性能和使用壽命。因此,深入研究SEI膜的形成機理、組成結構、穩定性及其影響因素,并進一步尋找改善SEI 膜性能的有效途徑,一直都是世界電化學界研究的熱點。
一、SEI膜的成膜機理早在上世紀70 年代,人們在研究鋰金屬二次電池時,就發現在金屬鋰負極上覆蓋著一層鈍化膜,這層膜在電池充放電循環中起著非常重要的作用,隨著對這種現象研究的深入,研究者們提出了這層鈍化膜大致的形成機理,并依靠這些機理,相繼提出了幾種鈍化膜的模型。在這些模型當中,SEI 膜模型得到人們普遍的應用,因此人們習慣于把這種鈍化膜稱為SEI膜。
1.1 鋰金屬電池早期,人們對鋰金屬電池研究較多。對于鋰金屬電池負極上的鈍化膜,一般認為是極其活潑的金屬Li與電解液中的陰離子反應,反應產物(大多不溶) 在金屬鋰表面沉積下來,形成一層足夠厚的、能夠阻止電子通過的鈍化膜。典型的反應式有:
PC + 2 e - + 2Li+ →CH3CH(OCO2Li) CH2 (OCO2Li) ↓+ CH3CH=CH2 ↑
2EC + 2 e - + 2Li+ →(CH2OCO2Li) 2 ↓+ CH2 =CH2 ↑
雖然該鈍化膜也不足以阻止鋰枝晶在充放電過程中的聚集,然而其研究結果對鋰離子電池的機理研究有極其重要的指導意義。
1.2 鋰離子電池鋰離子電池一般用碳材料(主要是石墨) 作負極,在SEI 膜形成的過程中,負極表面所發生的反應與金屬鋰負極相類似。Aurbach等認為可能的反應是由EC、DMC、痕量水分及HF等與Li+反應形成(CH2OCO2Li)2 、LiCH2CH2OCO2Li 、CH3OCO2Li 、LiOH、Li2CO3 、LiF等覆蓋在負極表面構成SEI膜,同時產生乙烯、氫氣、一氧化碳等氣體。主要的化學反應如下(電解液以EC/DMC + 1mol/L LiPF6 為例) :
2EC + 2e - + 2Li + →(CH2OCO2Li)2 ↓+ CH2=CH2 ↑
EC + 2e - + 2Li + →LiCH2CH2OCO2Li ↓
DMC + e - +Li + →CH3·+ CH3OCO2Li ↓ +And/or CH3OLi ↓+ CH3OCO·
traceH2O + e - +Li + →LiOH ↓+ 1/2H2
LiOH + e - +Li + →Li2O ↓+ 1/2H2
H2O + (CH2OCO2Li)2 →Li2CO3↓ + CO
2CO2 + 2e - + 2Li + →Li2CO3 ↓+ CO
LiPF6 + H2O →LiF + 2HF + PF3O
PF6- + ne - + nLi + →LiF↓ + LixPFy ↓
PF3O + ne - + nLi + →LiF↓+LixPOFy ↓
HF + (CH2OCO2Li)2 ↓,LiCO3 ↓→LiF ↓+ (CH2COCO2H)2 ,H2CO3 (sol.)
SEI膜持續生長,直到有足夠的厚度和致密性,能夠阻止溶劑分子的共插入,保證電極循環的穩定性。同時,氣體的產生機理也推動了開口化成工藝的優化。不過當前的研究仍處于定性階段,深入至定量的研究及各種成分的影響分析,將成為下一步的研究重點及難點,其研究結果也將更富有指導意義。
二、SEI膜的影響因素SEI 膜作為電極材料與電解液在電池充放電過程中的反應產物 ,它的組成、結構、致密性與穩定性主要是由電極和電解液的性質決定 ,同時也受到溫度、循環次數以及充放電電流密度的影響。
2.1 負極材料的影響負極材料的各種性質 ,包括材料種類、電極組成及結構、形態特別是表面形態對SEI 膜的形成有著至關重要的影響。人們對各種類型的碳負極材料 ,包括熱解碳、碳纖維、石油焦、人造石墨和天然石墨等進行了深入研究 ,結果表明材料的石墨化程度和結構有序性不同 ,所形成 SEI 膜的各種性質也不同;即使對同一種碳材料 ,微粒的表面不同區域 (基礎面和邊緣面) ,所形成的 SEI 膜也有很大差異。Kang[9]對碳負極形成 SEI 膜進行了研究 ,分析表明在這幾種碳材料 中 ,熱解碳形成的 SEI 層較厚,而高定向熱解石墨 ( HOPG) 上形成的 SEI 膜較薄。
Edstrom 等 對中間相碳微球 (MCMB) 和石墨作負極的 SEI膜的熱力學穩定性進行研究。實驗證明 ,負極 SEI膜的熱穩定性是由碳電極的類型決定的。把電極進行升溫處理 ,雖然各種碳負極剝落的起始溫度基本一致 ,但剝落程度和受溫度影響的范圍卻各不相同 ,這些差異主要是由電極的表面結構孔隙率和粒子大小不同造成的。
2.2 電解質的影響一般認為作為溶質的支持電解質鹽比溶劑更易還原,還原產物成為SEI 膜的一部分。在一些常用的電解質鋰鹽中LiClO4的氧化性太強,安全性差。LiAsF6 對碳負極電化學性能最好,但其毒性較大。LiPF6 熱穩定性差,60~80 ℃左右就有少量分解成為LiF。因此尋找新型鋰鹽的研究一直在不斷進行中。電解質鋰鹽的主要差別在于陰離子種類不同,造成SEI 膜的形成電位和化學組成有差別。用含 Cl、F等元素的無機鋰鹽作電解質時 ,SEI 膜中就會有這些電解質的還原物存在。實驗表明[10] ,在含有 Cl 和 F 的電解液中 ,SEI膜中的 LiF、 的含量都很高 ,這可能LiCl是以下反應所致 :
LiPF6 (solv) + H2O(l) →LiF(s) +2HF(solv) + POF3 (g)
LiBF4 (solv) + H2O(l) →LiF(s) +2HF(solv) + BOF(s)
并且 ,無機鋰鹽的分解也可能直接生成這些化合物:
LiPF6 (solv) →LiF (s) + PF5 (s)
由于在熱力學上生成無機鋰化合物的傾向較大 ,故使得所生成的 SEI膜能更穩定地存在 ,從而減弱 SEI膜在電化學循環過程中的溶解破壞。陽離子對 SEI 膜也有明顯影響。例如分別用LiPF6 和 TBAPF6 (TBA+ 為四丁基銨離子) 作電解質時 ,采用EIS分析發現后者的阻抗顯著增大 ,這主要是因為 TBA+體積較大 ,嵌入后使石墨層間距擴張較大 ,所以造成石墨電極的嚴重破壞。
2.3 溶劑的影響研究表明 ,電解液的溶劑對SEI膜有著舉足輕重的作用 ,不同的溶劑在形成SEI膜中的作用不同。在PC溶液中,形成的SEI膜不能完全覆蓋表面,電解液很容易在石墨表面反應,產生不可逆容量。在純 EC做溶劑時,生成的SEI 膜主要成分是(CH2OCOOLi)2 ,而加入DEC或DMC后,形成的SEI 膜的主要成分分別為C2 H5COOLi 和Li2CO3。顯然,后二者形成的SEI 膜更穩定。在EC/DEC和EC/DMC的混合體系中, EC是生成SEI 膜的主要來源,只有EC發生了分解, DEC和DMC的主要作用是提高溶液的電導率和可溶性,而不在于參與SEI 膜的形成。
有機電解質的溶劑一般需要具有高電導率、低粘度、高閃燃點和較高的穩定性等特點,這就要求溶劑的介電常數高,粘度小。烷基碳酸鹽如PC、EC等極性強,介電常數高,但粘度大,分子間作用力大,鋰離子在其中移動速度慢。而線性酯,如DMC(二甲基碳酸脂)、DEC (二乙基碳酸脂)等粘度低,但介電常數也低,因此,為獲得滿足需求的溶液,人們一般都采用多種成分的混合溶劑如PC十DEC,EC+DMC等。
Peled 等分析了采用幾種不同配比的EC/PC、EC/DMC 做溶劑時高溫條件下SEI 膜的嵌脫鋰性能。研究表明,雖然室溫下電解液中含有PC 會在電極表面形成不均勻的鈍化層,同時易于產生溶劑共嵌入而使碳電極破壞,但PC 的加入卻有利于提高電極高溫循環性能,具體原因有待于進一步研究。
2.4 溫度的影響一般認為,高溫條件會使SEI 膜的穩定性下降和電極循環性能變差,這是因為高溫時SEI 膜的溶解和溶劑分子的共嵌入加劇,而低溫條件下SEI 膜趨于穩定。 Ishiikawa 在優化低溫處理條件時發現, 在- 20 ℃時生成SEI 膜循環性能最好,這是因為低溫時形成的SEI 膜致密、穩定, 并且阻抗較低。Andersson則認為高溫條件下,原來的膜進行結構重整,膜的溶解與重新沉積使新的膜具有多孔的結構,從而使得電解液與電極產生進一步接觸并繼續還原。目前在鋰離子電池制造商中普遍采用的化成后在30 —60 ℃之間保溫老化,以改善電池的循環性能和優化電池的貯存性能,就是基于在較高溫度下SEI 膜的結構重整之說。
2.5 電流密度的影響電極表面的反應是一個鈍化膜形成與電荷傳遞的競爭反應。由于各種離子的擴散速度不同和離子遷移數不同,所以在不同的電流密度下進行電化學反應的主體就不相同,膜的組成也不同。Dollé 在研究SEI 膜時發現,電流密度對膜的厚度影響不大,卻使得膜的組成截然不同。低電流密度時,Li2CO3 首先形成,而ROCOOLi 則延遲到電極放電結束前才開始形成;高電流密度時,ROCOOLi沒有在膜中出現,膜中只含有Li2CO3 ,這使得膜的電阻變小,電容增大。
Hitoshi Ota等人在對以PC(碳酸丙稀酯) 和ES(亞硫酸乙烯酯) 基電解液系統的碳負電極進行研學手段對SEI 膜形成機理作了介紹。試驗研究表明: SEI 膜的產生主要是由PC 和ES 的分解而形成的,且ES 在PC 之前分解,SEI 膜的組成結構主要取決于電流密度。如果電流密度高,SEI 膜的無機組分首先在該高電位下形成,鋰離子的插入開始,此后SEI 膜的有機組分形成。而當電流密度較低時,從初始電位開始(1.5 V ,versus Li/ Li + ) ,SEI 的有機組分立即形成。
三、SEI膜的改性根據 SEI膜的形成過程、機理及其性能特征 ,人們采用各種方法對SEI膜進行改性 ,以求改善其嵌脫鋰性能 ,延緩 SEI 膜的溶解破壞 ,增強穩定性 ,同時減少 SEI膜形成過程中鋰離子的損失。目前 ,對SEI 膜的改性主要是通過對碳負極和電解液改性實現的。
3.1 碳負極改性碳負極的改性方法有多種:包覆、機械研磨、表面成膜都是有效的方法。對石墨電極表面氧化、氣體還原處理、高溫熱處理、惰性氣體清洗以及低溫預處理都能在一定程度上改善電極表面的 SEI膜 ,增強其穩定性與循環性能 ,減少不可逆容量 ,增大充放電效率。
包覆是一種有效的改性方法 ,可以使負極的循環性能得到很大的改善。這主要歸因于石墨外表面包上一層碳殼 ,能形成薄而致密的SEI膜 ,有效地抑制溶劑化鋰離子的共嵌入 ,阻止循環過程中石墨層的脫落。
氧化也是一種優良的碳負極改性方法。氧化可以除去碳電極的表面活性高的部分 ,使電極的微孔增加 ,形成的 SEI 膜有利于 Li 離子的通過;同時它表層的氧化物部分能形成與電極鍵合的 SEI膜 ,從而大大增強了膜的穩定性。
3.2 電解液在SEI膜的改性方面 ,電解液是另一個重要的方面。在選擇合適電解液的基礎上通過加入合適添加劑 ,能夠形成更穩定的 SEI膜 ,提高電極表層分子膜的穩定性,減少溶劑分子的共嵌入。
3.2.1有機成膜添加劑硫代有機溶劑是重要的有機成膜添加劑,包括亞硫酰基添加劑和磺酸酯添加劑。ES(ethylene sulfite, 亞硫酸乙烯酯)、PS(propylene sulfite, 亞硫酸丙烯酯)、DMS(dimethylsulfite, 二甲基亞硫酸酯)、DES(diethyl sulfite, 二乙基亞硫酸酯)、DMSO(dimethyl sulfoxide, 二甲亞砜)都是常用的亞硫酰基添加劑,研究了發現添加劑活性基團的吸電子能力是決定添加劑在電極表面SEI 膜形成電位的重要因素,而與Li+在電解液中的溶劑化狀況無關。Ota 等證實了亞硫酰基添加劑還原分解形成SEI膜的主要成分是無機鹽Li2S、Li2SO3 或Li2SO4 和有機鹽ROSO2Li, Wrodnigg 等比較了不同亞硫酰基化合物的電化學性能,發現其在碳負極界面的成膜能力大小依次為:ES》PS》》DMS》DES,指出鏈狀亞硫酰基溶劑不能用作PC基電解液的添加劑,因為它們不能形成有效的SEI 膜,但可以與EC溶劑配合使用,高粘度的EC 具有強的成膜作用,可承擔成膜任務,而低粘度的DES 和DMS 可以保證電解液優良的導電性。磺酸酯是另一種硫代有機成膜添加劑,不同體積的烷基磺酸酯如1,3-丙烷磺酸內酯、1,4-丁烷磺酸內酯、甲基磺酸乙酯和甲基磺酸丁酯具有良好的成膜性能和低溫導電性能,是近年來人們看好的鋰離子電池有機電解液添加劑。
鹵代有機成膜添加劑包括氟代、氯代和溴代有機化合物。這類添加劑借助鹵素原子的吸電子效應提高中心原子的得電子能力,使添加劑在較高的電位條件下還原并有效鈍化電極表面。鹵代EC、三氟乙基膦酸[tris(2,2,2-trifluoroethyl)phosphite, 簡稱TTFP]、氯甲酸甲酯、溴代丁內酯及氟代乙酸基乙烷等都是這類添加劑。在PC 基電解液中加入10%的1,2-三氟乙酸基乙烷[1,2-bis-(trifluoracetoxy)-ethane, 簡稱BTE]后,電極在1.75V(vs.Li/Li+)發生成膜反應,可有效抑制PC 溶劑分子的還原共插反應,并允許鋰可逆地嵌入與脫嵌,提高碳負極的循環效率。氯甲酸甲酯、溴代丁內酯的使用也可以使碳負極的不可逆容量降低60%以上。
其它有機溶劑:碳酸亞乙烯酯(vinylene carbonate, 簡稱VC)是目前研究最深入、效果理想的有機成膜添加劑。Aurbach在1mol/L 的LiAsF6/EC+DMC(1/1)電解液中加入10%的VC 后,利用分光鏡觀察電極表面,證實VC 在碳負極表面發生自由基聚合反應,生成聚烷基碳酸鋰化合物,從而有效抑制溶劑分子的共插反應,同時對正極無副作用。Matsuoka 等研究了VC 在1 mol/L 的LiAsF6/EC+EMC(ethyl methyl carbonate, 乙基甲基碳酸酯)(1/2)電解液中的作用,證實VC 可使高定向熱解石墨(highly oriented pyrolytic graphite, 簡稱HOPG)電極表面裂縫的活性點失去反應活性,在HOPG 電極表面形成極薄的鈍化膜(厚度小于10nm),該鈍化薄膜是由VC 的還原產物組成,具有聚合物結構。另據Sony 公司的專利報道,在鋰離子電池非水電解液中加入微量苯甲醚或其鹵代衍生物,能夠改善電池的循環性能,減少電池的不可逆容量損失,這是因為苯甲醚和電解液中EC、DEC(diethyl carbonate, 二甲基碳酸酯)的還原分解產物RCO3Li 可以發生類似于酯交換的基團交換反應,生成CH3OLi 沉積于石墨電極表面,成為SEI 膜的有效成分,使得SEI 膜更加穩定有效,降低循環過程中用于修補SEI 膜的不可逆容量。
3.2.2 無機成膜添加劑優良的無機成膜添加劑的種類和數目至今仍然十分有限。CO2在電解液中溶解度小,使用效果并不十分理想;相比之下,SO2的成膜效果和對電極性能的改善十分明顯,但與電池處于高電位條件下的正極材料相容性差,難以在實際生產中使用。無機固體成膜添加劑的研究最近也有了一些進展,Shin等在1mol/L,LiPF6/EC+DMC體系中添加飽和Li2CO3后,電極表面產生的氣體總量明顯減少,電極可逆容量明顯提高。Choi 等利用SEM、EDX 和FT-IR 研究電極表面結構與組成的變化,認為SEI膜的形成是Li2CO3在電極表面沉積和溶劑還原分解共同作用的結果。Li2CO3的加入一方面有助于電極表面形成導Li+性能優良的SEI膜,同時也在一定程度上抑制了EC和DEC的分解反應。在LiClO4作鋰鹽電解質的電解液中加入少量NaClO4,也可以降低電極不可逆容量,改善循環性能,這是因為Na+的加入改變了電解液內部Li+的溶劑化狀況和電極界面成膜反應的形式,SEI 膜的結構得到了優化的緣故。
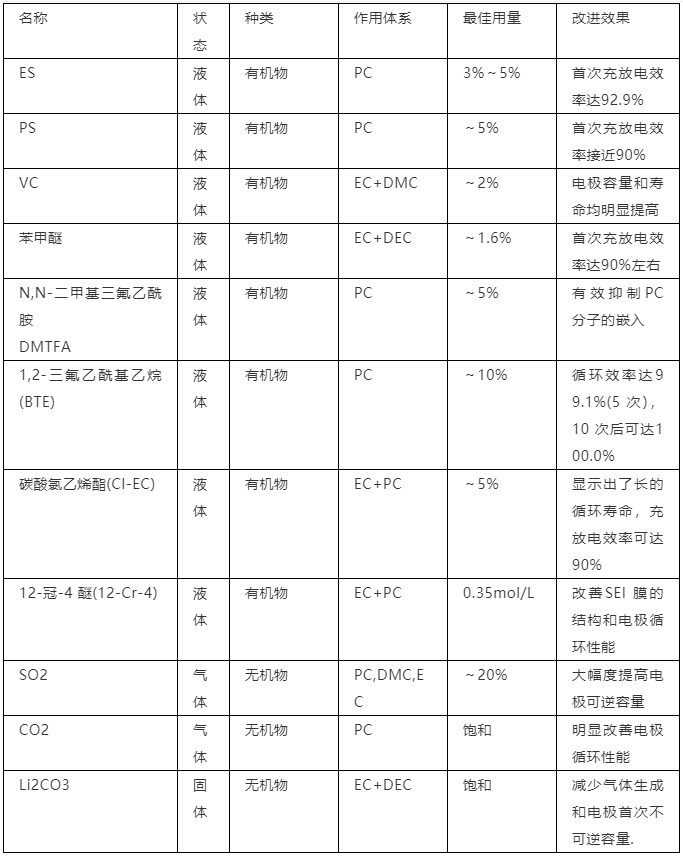
3.2.3 代表性成膜添加劑的比較 表1 列出了一些代表性成膜添加劑的名稱、作用體系、最佳用量和改進效果等情況,可見,雖然有效的成膜添加劑種類很多,但不同添加劑的作用體系、用量和改進效果的差別十分明顯。表1 代表性成膜添加劑的比較
審核編輯 :李倩
-
鋰離子電池
+關注
關注
85文章
3242瀏覽量
77741 -
sei膜
+關注
關注
0文章
23瀏覽量
3548
原文標題:搞懂SEI膜,這一篇就夠了
文章出處:【微信號:Recycle-Li-Battery,微信公眾號:鋰電聯盟會長】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
鋰離子電池SEI膜的性能影響
SEI膜的性能作用分析

SEI膜究竟如何影響鋰電池性能
光膜和啞膜哪個好_光膜和啞膜的區別
SEI膜是怎么形成和變化的?





 了解SEI膜:SEI膜的成膜機理
了解SEI膜:SEI膜的成膜機理










評論