細胞核內的蛋白質在基因的調控、翻譯和表達的過程中扮演著重要的角色,常與腫瘤發生、轉移以及耐藥性有關。但核蛋白被細胞膜和核膜的雙重屏障包圍,實際檢測中,面臨比細胞質蛋白檢測更多困難。常規蛋白質免疫印跡法、酶聯免疫吸附實驗和免疫沉淀法均需要將細胞裂解,無法滿足活細胞實時檢測。而活細胞狀態下檢測細胞核蛋白主要方法,如分子熒光染料法和質粒表達法,需要特定篩選條件而缺乏一定的適用性,不能滿足需求內源核蛋白的精準檢測。
據麥姆斯咨詢報道,近日,北京航空航天大學常凌乾課題組在《Biosensors and Bioelectronics》期刊上發表了題為“Companion-Probe & Race Platform for Interrogating Nuclear Protein and Migration of Living Cells”的研究論文。該工作設計了一種新型分析生物芯片平臺(CPR),能在活細胞中探測核蛋白,同時實時追蹤細胞的遷移;該芯片結合納米電穿孔技術(課題組標簽技術),將一種攜帶有識別細胞核內蛋白特異性識別肽的相伴型組合探針遞送進活細胞核內,到檢測到靶蛋白后產生綠色熒光。為了追蹤活細胞的遷移,作者在平臺上設計了多個帶有標志點的放射狀微通道,作為細胞的可尋址跑道。通過記錄細胞在一定時間內經過的標志點的數量,可以監測細胞的遷移距離和估計遷移速度(圖1)。
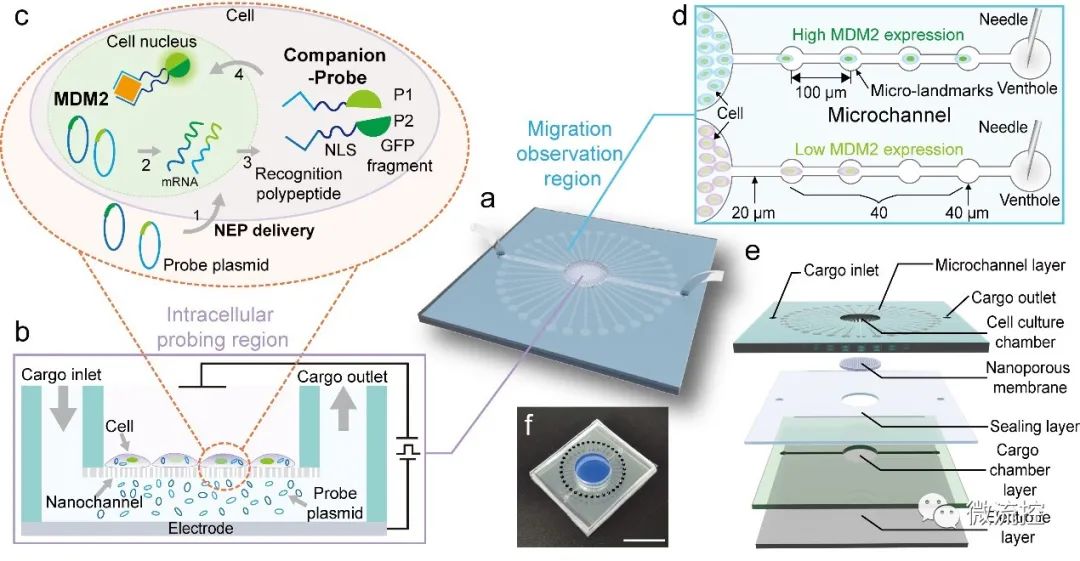
圖1用于探測活細胞核內蛋白和遷移行為的CPR平臺原理圖
作者將40個標記點定義為四個部分,從細胞內探測區域的邊緣(起點)到微通道的靜脈孔,每十個標記點設為一組間隔。課題選擇與細胞遷移率相關的MDM2蛋白作為檢測蛋白,其表達水平與細胞遷移速度呈正相關。綜合分析結果顯示,45%以上的MDM2蛋白過表達的細胞遷移到20號-40號微標記,而對照組細胞只在20號微標記內遷移,表明MDM2蛋白過表達的細胞的遷移能力增強。作者根據在遷移觀察區移動的時間和細胞的遷移距離估計了這些細胞的遷移速度,并驗證了MDM2蛋白過表達的細胞的速度明顯快于對照細胞。通過CPR平臺和MATLAB軟件計算的遷移速度具有可比性,證明了CPR平臺在一定時期內通過簡單地計算標記點來評估細胞遷移速度的可行性。根據MDM2蛋白表達和細胞遷移速度的關系分析,MDM2蛋白的表達水平與細胞遷移速度呈正相關關系(圖2)。這一結果與報道的MDM2蛋白高表達促進腫瘤遷移的研究一致。
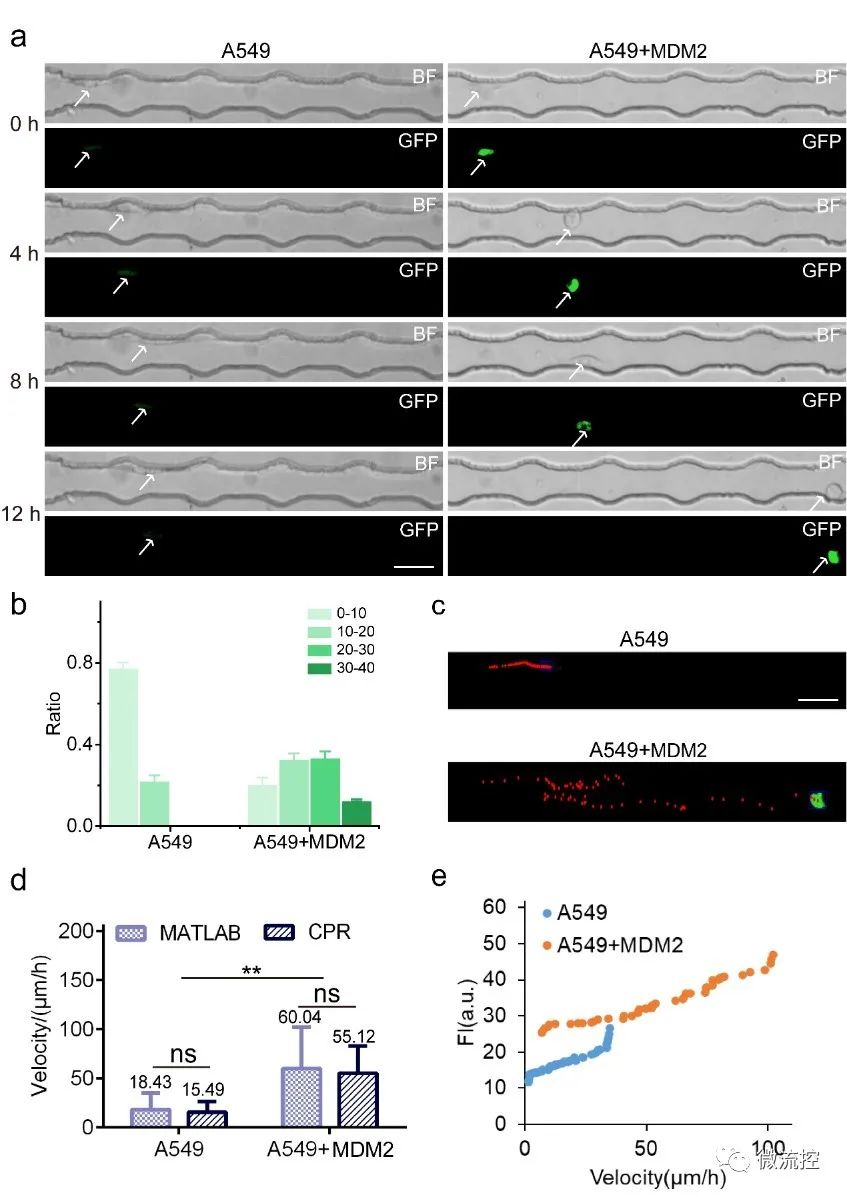
圖2細胞遷移分析的CPR平臺
為評估CPR平臺的多功能性,作者在CPR平臺上分析了六個原發性肺腫瘤細胞樣本(T1-T6)和六個原發性正常肺細胞樣本(N1-N6)細胞核內MDM2表達。在所有六個原發性肺腫瘤細胞的細胞核中都觀察到明顯的綠色熒光,表明MDM2蛋白在腫瘤細胞中的高表達。研究發現,相同時間內,原發性肺腫瘤細胞比原發性正常肺細胞遷移得更遠(圖3)。原代細胞的成功檢測顯示了CPR平臺在分析不同來源的細胞樣本方面的高度通用性。
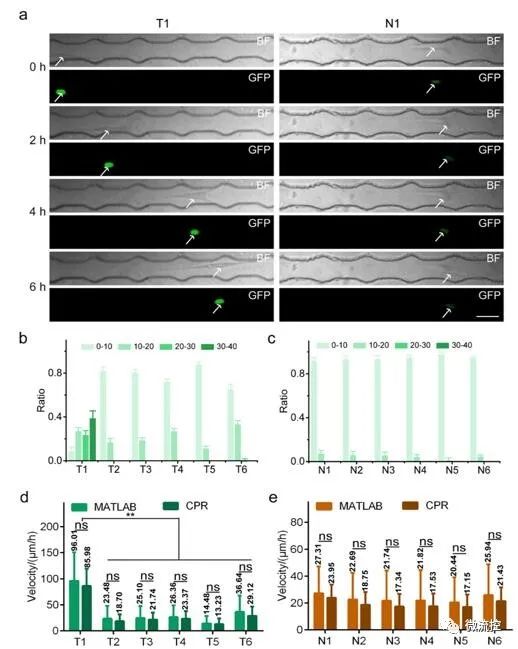
圖3用于跟蹤原代細胞遷移的CPR平臺
該研究第一單位為北京市生物醫學工程高精尖創新中心和北京航空航天大學生物與醫學工程學院。常凌乾教授為主要通訊作者。第一作者為孫宏博士、董再再博士和張清洋博士。文章的其他主要共同作者包括,中國科學院大學深圳先進技術研究院任培根研究員,北京大學腫瘤醫院吳楠教授。
文章鏈接:
https://doi.org/10.1016/j.bios.2022.114281
審核編輯 :李倩
-
納米
+關注
關注
2文章
698瀏覽量
37046 -
生物芯片
+關注
關注
3文章
79瀏覽量
17078
原文標題:北航研發活細胞核蛋白和遷移行為綜合分析生物芯片
文章出處:【微信號:MEMSensor,微信公眾號:MEMS】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
一種新型多類別生物芯片DNA基因表達數據標準化方法
生物芯片概念及發展歷史和前景
生物芯片分類及應用
利用發光蛋白開發出一種新型生物傳感器
如何使用FPGA設計生物芯片數據采集系統的設計方法資料概述
上海生物芯片推出信號通路分析系統
生物芯片 生物芯片技術
山東農業大學研發了一種生物傳感器檢測TET1蛋白
多指標體外檢測系統的量子點液態生物芯片應用





 一種新型分析生物芯片平臺,能在活細胞中探測核蛋白
一種新型分析生物芯片平臺,能在活細胞中探測核蛋白











評論