1. CFDA2016年第173號《醫療器械生產企業質量控制與成品放行指南》中要求醫療器械行業在生產和質量管理中運用統計技術進行分析和預測。
2. FDA要求醫療器械行業抽樣方案應當具有統計學依據,應當對統計推斷的置信度進行分析,確保抽檢的樣品具有代表性。
3. 企業應當收集與產品質量控制、成品放行相關的質量控制運行數據,采用適當的統計技術,定期對相關數據進行趨勢分析
醫療器械可靠性分析
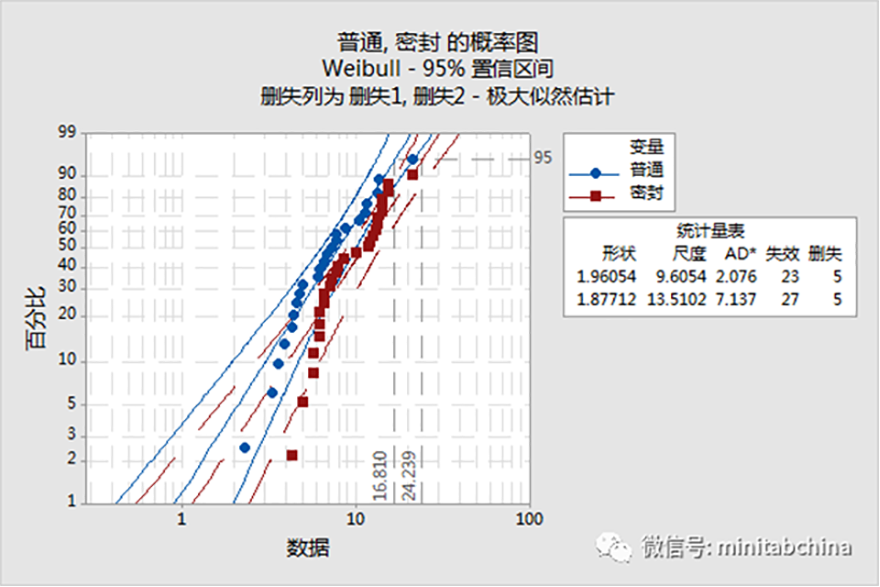
分析醫療器械在使用中受使用強度、電壓、溫度影響下器械的可靠性分析。
識別影響產品可靠性的失效模式。
?
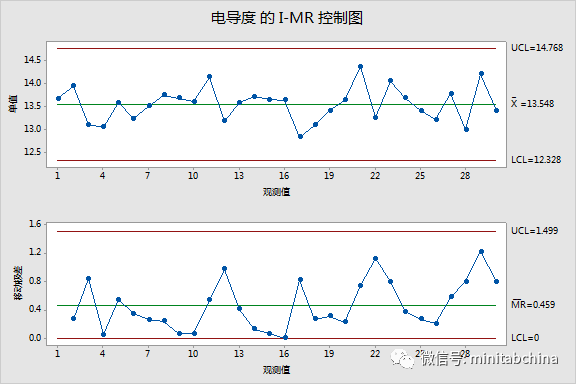
生產中過程監控
企業應當收集與產品質量控制、成品放行相關的質量控制運行數據,采用適當的統計技術,定期對相關數據進行趨勢分析。
形成階段性產品質量控制報告,警戒可能產生的偏離,按規定處置偏離或超限事件,必要時及時采取糾正預防措施。
企業應當定期對產品質量控制、成品放行控制的適宜性、充分性、有效性進行評審,并實施必要的后續措施。
通過觀察和判斷,適當時結合測量、試驗或估量所進行的符合性評價。(GB/T 19000-2008《質量管理體系基礎和術語》)
?
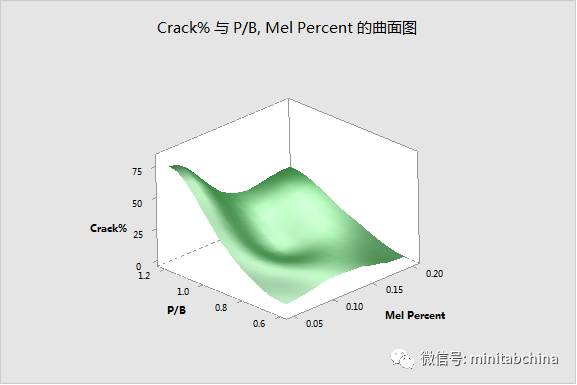
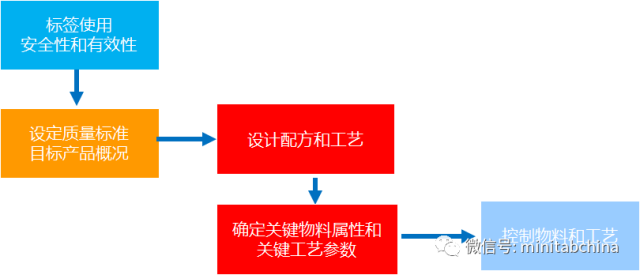
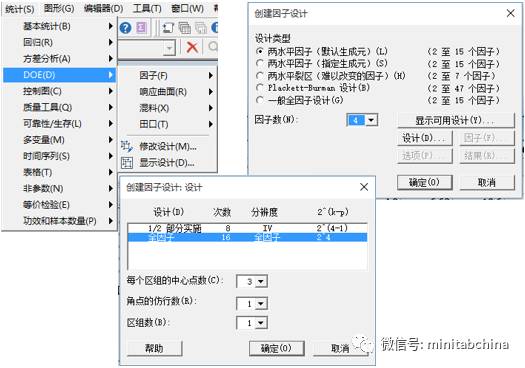
質量源于設計QbD
醫療器械的過程確認中,如何實現質量改進和成本節約?
各種工藝參數怎么設置才可以滿足監管的需求?
全球醫療器械協調工作組(GHTF)要求對過程進行確認,其中,操作鑒定(OQ)就要求用實驗設計的方法。
?
?
審核編輯 黃昊宇
-
醫療器械
+關注
關注
19文章
862瀏覽量
52246 -
Minitab
+關注
關注
0文章
187瀏覽量
11925 -
醫療器械行業
+關注
關注
1文章
22瀏覽量
14902
發布評論請先 登錄
相關推薦
醫療器械質量保障新引擎:宏控UTP自動化測試系統

工業數據采集網關在醫療器械制造行業的應用


盤谷醫療器械進銷存系統各地區醫療器械協會認可
DEKRA德凱助力醫療器械高質量發展
醫療器械中電磁干擾的來源及影響

如何編制有源醫療器械設計開發流程?


X1E000251005900晶振應用于醫療器械血糖儀

上海國際醫療器械展覽會2025年6月25日-27日舉辦
醫療器械密封性負壓測試儀評估



















評論