大多數體內組織細胞存在于三維細胞外基質(ECM)中。為了更好地研究細胞生理學和病理生理學,越來越需要類似于體內的微環境以培養細胞,目前正在研究的策略包括水凝膠、球體、組織支架和非常有前景的微流控系統。
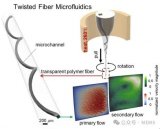
近期,大連理工大學的李經民課題組,提出了一種3D打印支架集成的“三明治”結構微流控裝置,用于三維動態細胞培養。研究發現,該微流控裝置具有良好的生物相容性和可行性,在體外細胞研究、組織工程和腫瘤治療藥物篩選方面具有巨大的潛力。相關研究以 “Engineering a dynamic three-dimensional cell culturing microenvironment using a ‘sandwich’ structure-liked microfluidic device with 3D printing scaffold”為題發表在Biofabrication期刊上。
在二維細胞培養技術中,細胞生長在平板上,難以模擬體內復雜的三維微環境。近幾十年來,微流控技術被廣泛采用,以提供簡單、有效的3D空間來加速細胞聚集并指導細胞球體的形成,可用于3D動態細胞培養。基于此,李經民課題組提出了一種模擬細胞外基質和微循環的體外三維培養模型的建立方法。使用熱輔助電液動力噴射(TAEJ)打印技術設計的3D微流控裝置具有“三明治”狀夾層結構,包括上層、支架層和底層。用其進行HeLa細胞的三維培養,并與48孔板和無支架裝置中的二維培養細胞進行比較。
“三明治”式微流控裝置的設計
活體細胞存在于復雜的三維微環境中,其中存在諸如可溶性因子、細胞-細胞接觸、細胞-細胞外基質相互作用和流體流動引起的剪應力等因素(圖1a)。受體內細胞三維微環境的啟發,該研究設計了一種能夠為細胞培養提供三維組織支架和動態液的夾心式微流控裝置。該裝置由三層組成,即上層、支架層和底層(圖1b)。圖1c顯示了微流控裝置和不同上下層結構的相應位置。
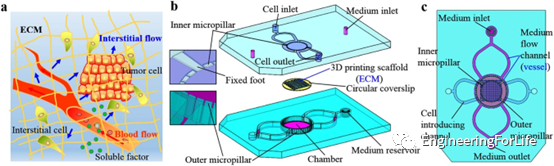
圖1 微流控裝置的設計
微流控裝置的制作
微流控裝置的上層和底層是用聚二甲基硅氧烷(PDMS)通過復制母片上的結構來制造的(圖2a)。支架層利用PCL/PVP復合生物聚合物墨水并采用TAEJ印刷技術制造(圖2b)。最后,使用氧等離子體處理整個裝置(圖2c),進行不可逆地粘合。
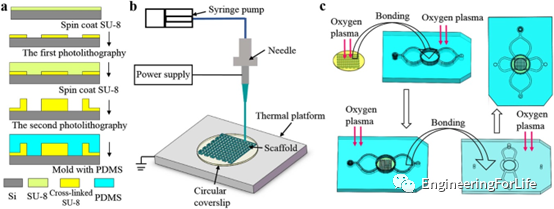
圖2 微流控裝置的制造工藝示意圖
微流控裝置的結構
圖3a顯示了用于打印3D PCL/PVP支架的設備。圖3b可見3D打印支架的掃描電子顯微鏡圖像,該支架的支架纖維平均寬度約為12微米,相鄰纖維之間的平均距離約為70微米。圖3c為支架的三維輪廓,呈現出均勻而光滑的特征。圖3d為PDMS上層的斷面圖像,內部微柱為上板的凸起,凸起的高度為50微米。圖3e是底部PDMS層的截面圖像,小室的深度等于外部微柱的高度,即200微米。圖3f是粘合裝置的截面圖像,可防止因流體流動而產生的變形沖刷,提高了支架結構的穩定性。圖3g是用于粘合三層的設備。經氧等離子體處理后,將一片PDMS放在上板的下表面,另一片放在底板的上表面,并在范德華力的作用下可逆結合。然后,通過調整,將兩個PDMS塊在Z方向上對齊。最后,將兩個PDMS片不可逆地粘合在一起(圖3h)。圖3i可見粘合的裝置充滿了紅色墨水,表明裝置內的流動狀況良好。
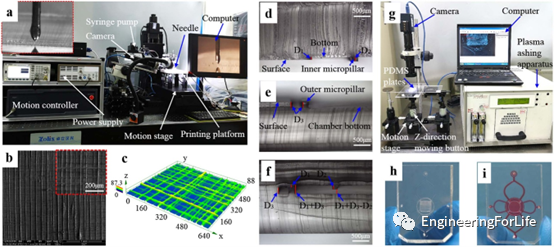
圖3 微流控裝置的設備和結構 支架對裝置內流場的影響
為了研究3D打印支架對裝置內流場條件的影響,定性上,通過比較顏色的漸變,可以觀察到控制室(圖4a)中的流速明顯快于支架區域 (圖4b)。圖4c顯示了沿交叉線的速度曲線,這些拋物線狀曲線表明,室內的流場分布明顯不均勻。相反,支架區域的流場分布更均勻,交叉線的曲線相對平滑(圖4d)。在圖4e-f中,藍色軌跡的長度表明控制室的平均速度比支架區域的平均速度快。圖4g顯示了不同設備中平均跟蹤粒子速度的小提琴曲線圖。紅點和藍點表示速度樣本的中位數,可見紅色小提琴區(無支架裝置)的高度大于藍色(有支架裝置)的高度,前者的速度分布更分散,說明支架可以為細胞培養提供更均勻的流動微環境。
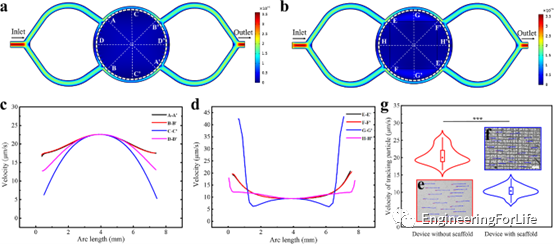
圖4 微流控裝置內的流場狀況及3D打印支架對其流場的影響
墨水流動模擬細胞培養過程
為了展示細胞培養過程,研究了不同顏色油墨的流動行為。首先,在引入HeLa細胞懸液(藍色墨水)之前,在裝置中裝滿培養液(紅色墨水)以去除氣體。用塞子堵住細胞入口和細胞出口,通過將培養液入口連接到注射器泵上,將培養液注入設備(圖5a)。輸注20s后,將細胞懸液(藍色墨水)注入裝置,多余的細胞懸液從細胞出口溢出。培養液入口和出口用塞子堵塞(圖5b)。結果表明,輸入20s后,培養室內充滿藍色墨水。靜置6h后,將培養液輸入,細胞入口和細胞出口被堵塞(圖5c)。可見灌裝500s后,該裝置充滿了紅墨水,表明培養室內裝滿了培養液,廢液從培養液出口流出。
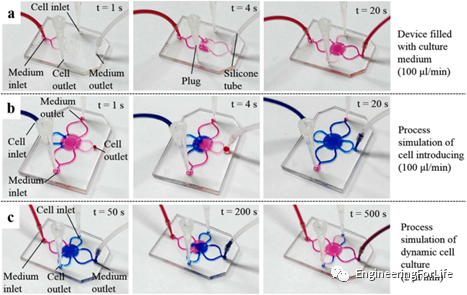
圖5 Exo-TDN的肝臟保護作用研究 在裝置和平板中培養HeLa細胞
在3D打印支架的微流控裝置中培養HeLa細胞,研究其生物相容性和可行性。圖6a-c分別顯示了引入微流控裝置和平板中的HeLa細胞的初始狀態。6d-f分別顯示了HeLa細胞在微流控裝置內和平板內培養72h的狀態。可見,在有支架的小室中,HeLa細胞在明場上的觀察受到了干擾。因此需結合活/死(綠/紅)染料染色,以進一步估計細胞密度(圖6g-i)。這些熒光圖像中細胞亮度的變化可能表明HeLa細胞在不同的深度附著在支架上。圖6j-l分別顯示了HeLa細胞在有支架裝置、無支架裝置和48孔板中的空間分布重建。相應地,3D重建的X-Z截面如圖6m-o所示,以表征細胞在高度(Z軸)方向上的分布。可以明顯觀察到,支架裝置的細胞三維重建高度明顯大于對照組。圖6p顯示帶有支架的裝置中的細胞密度顯著大于對照裝置和平板中的細胞密度。表明,三維動態培養模型在促進細胞生長方面具有優勢。根據活/死染色結果計算活細胞數與總細胞數之比,評價HeLa細胞的存活率。如圖6q所示,平板和對照裝置中的細胞存活率為86.7%和90.8%,而支架微流控裝置細胞存活率為95.3%,優于對照組。圖6r顯示了培養72h后,有支架微流控裝置的細胞縱橫比中位數約為3.2,是平板和無支架裝置的1.5倍以上。結果表明,支架可以促進細長和紡錘形的HeLa細胞的形態發生。
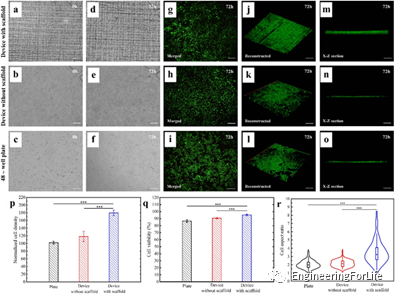
圖6 HeLa細胞生長在微流控裝置和平板內
微流控裝置和平板中DOX的細胞毒性評價
實驗結果表明,在不同濃度的DOX作用下,支架組的細胞存活率始終高于對照組,且細胞存活率隨DOX濃度的增加而降低。較高濃度的DOX對HeLa細胞存活率的影響較低濃度的細胞更為顯著,除了藥物傳遞效率低下外,3D支架中形成的體內類微環境可能在耐藥中發揮重要作用,因為較高的細胞密度限制了DOX對3D類組織結構的滲透。此外,從熒光圖像中可以明顯地觀察到DOX作用24h后細胞形態的變化,支架裝置的細胞長寬比中位數仍然高于其他組,意味著治療后細胞的去極化行為也表現出對DOX的劑量依賴性反應,與細胞活力是一致。以上結果表明,具有支架的微流控裝置,為體外細胞研究、組織工程和腫瘤治療藥物篩選提供自然的微環境(圖7)。
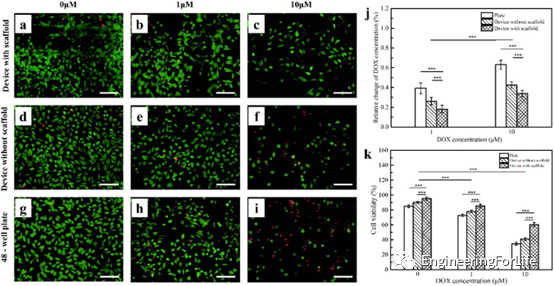
圖7 微流控裝置和平板中的HeLa細胞經不同濃度的DOX處理24h后的細胞毒性研究
綜上所述, 研制了一種“三明治”結構的微流控裝置,用于在有流體流動的三維微環境中進行動態細胞培養。該裝置由三層組成,上層用于引入細胞和固定支架,中間層模仿細胞外基質提供3D附著區,底層模仿血管為細胞提供動態培養液。利用3D打印技術和微細加工技術成功地制作了該器件。該支架可以為細胞培養提供更穩定的流體微環境,具有良好的流動性,促進了細胞的生長和活力。DOX的體外細胞毒性評估證實,采用3D支架模擬體內微環境的裝置具有更高的耐藥性。可為體外細胞研究、組織工程和腫瘤治療藥物篩選提供良好的微環境。
論文鏈接:
https://doi.org/10.1088/1758-5090/ac8a19
審核編輯 :李倩
-
微流控
+關注
關注
16文章
539瀏覽量
18953 -
3D打印
+關注
關注
26文章
3561瀏覽量
109490
原文標題:基于集成3D支架的微流控裝置,構建動態三維細胞培養微環境
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
干貨 什么是變壓器三明治繞線法

FPC與3D打印技術的結合 FPC在汽車電子中的應用前景
3D打印技術應用的未來
領麥微紅外測溫傳感器在小型光敏3D打印機中的創新應用





 一種3D打印支架集成的“三明治”結構微流控裝置
一種3D打印支架集成的“三明治”結構微流控裝置














評論