神經系統功能的維持需要消耗大量的ATP。線粒體通過氧化磷酸化產生ATP,是神經元細胞能量的主要來源。由于神經元軸突高度特化的結構以及ATP在軸突中有限的擴散能力,軸突線粒體的穩態對于維持神經元軸突的能量代謝與功能至關重要。在成熟的中樞神經系統神經元中,軸突一旦受到急性損傷,軸突線粒體的功能與運輸均出現異常,導致受損軸突局部面臨能量缺失的壓力,最終將導致軸突退化以及再生失敗。受限于研究方法,在動物模型中很難對損傷后軸突中的線粒體動態以及能量代謝變化進行實時觀察。2005年Taylor等人報道了利用微流控芯片分離神經元軸突的方法,為研究軸突損傷后線粒體穩態與能量代謝的分子調控機制提供了有力的研究工具。
近日,美國國立衛生研究院盛祖杭課題組在Cell Regeneration上發表了題為“Microfluidic devices as model platforms of CNS injury-ischemia to study axonal regeneration by regulating mitochondrial transport and bioenergetic metabolism”的方法論文章。該研究主要通過結合微流控芯片裝置與活細胞動態觀察技術,為研究中樞神經系統損傷后軸突內線粒體運輸、能量代謝、蛋白質合成等細胞生物學事件提供了新的研究方法。

首先,研究人員參考Taylor等人的報道設計微流控芯片,并利用該裝置將體外培養的中樞神經系統神經元的軸突與胞體和樹突分離。隨后,使用機械損傷、低糖低氧等方法模擬體內軸突損傷和腦卒中等急性應激,觀察神經元軸突急性損傷后退化和再生的過程。與之前在動物模型中的研究一致,成熟的中樞神經系統神經元在受到急性損傷后出現明顯的軸突退化、再生失敗等表型。
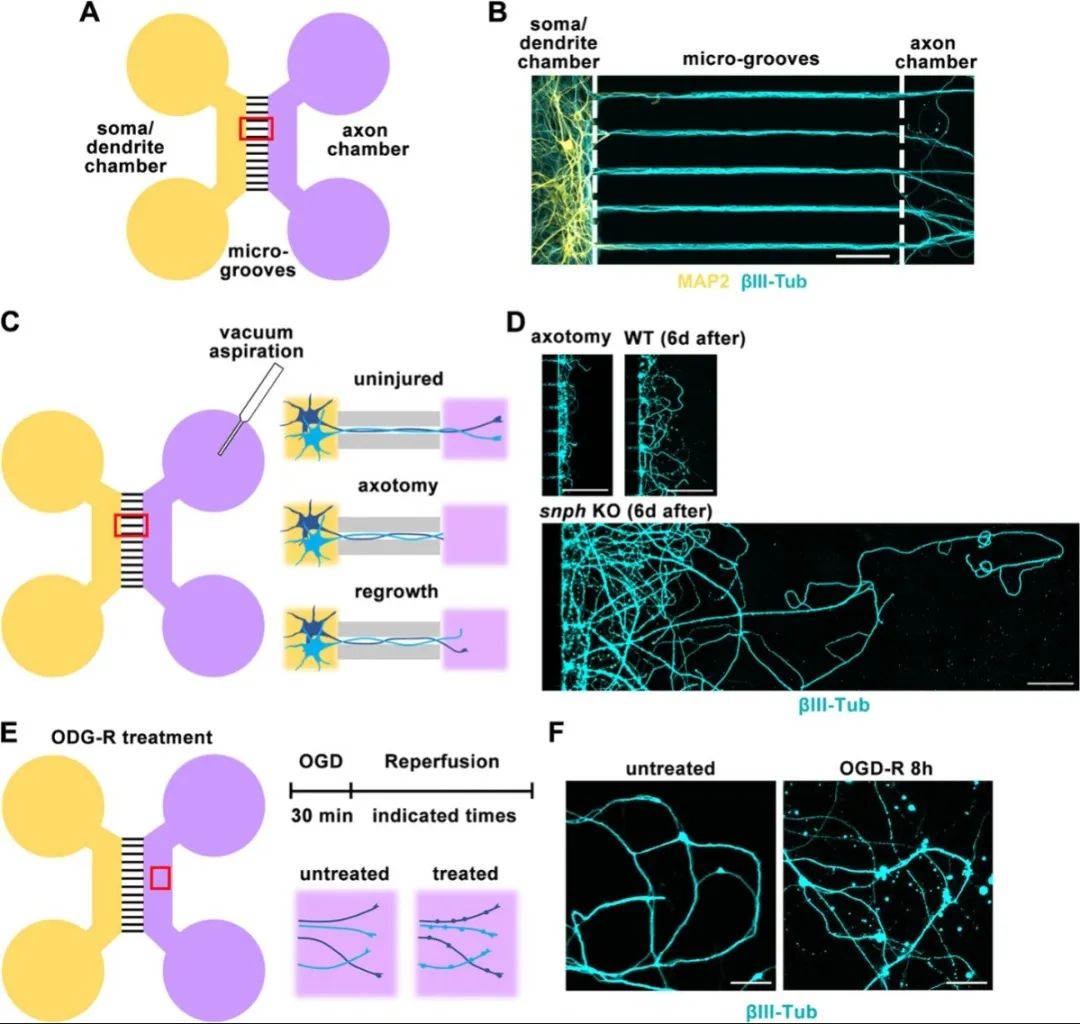
使用微流控芯片建立神經元損傷與低糖低氧模型
接著,使用熒光探針GO-ATeam2實時指示神經元中的ATP水平后發現,軸突損傷和低糖低氧狀態下,軸漿、軸突末端、神經元胞體的ATP水平呈現出不同的變化趨勢和應答時序。使用熒光蛋白標記軸突線粒體后發現,軸突損傷阻斷軸突線粒體的雙向運輸,并且在損傷12小時后難于恢復;而低糖低氧刺激后,軸突線粒體的逆向運輸相比于正向運輸表現出明顯的回復趨勢,暗示著神經元在兩種應激之間不同的分子應答機制。
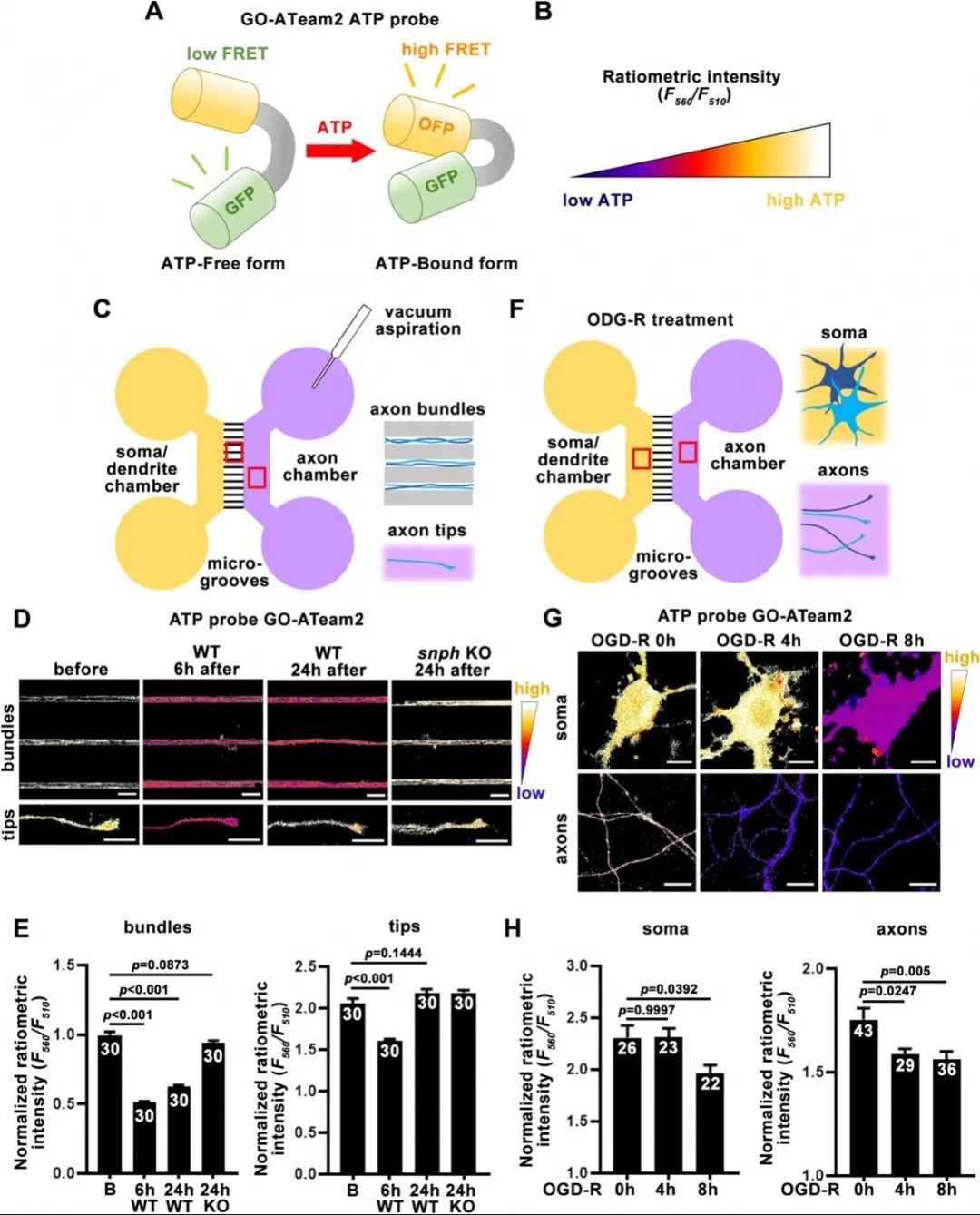
使用ATP探針Go-ATeam2檢測神經元不同損傷后能量代謝的動態變化
最后,利用嘌呤霉素-近端標記技術對軸突中特異蛋白的合成進行了原位檢測。結果顯示在低氧低糖狀態下,線粒體激酶PAK5在軸突中的蛋白合成水平明顯增高,8小時后逐漸恢復,而線粒體蛋白Miro-1在軸突中的蛋白合成水平沒有顯著變化。
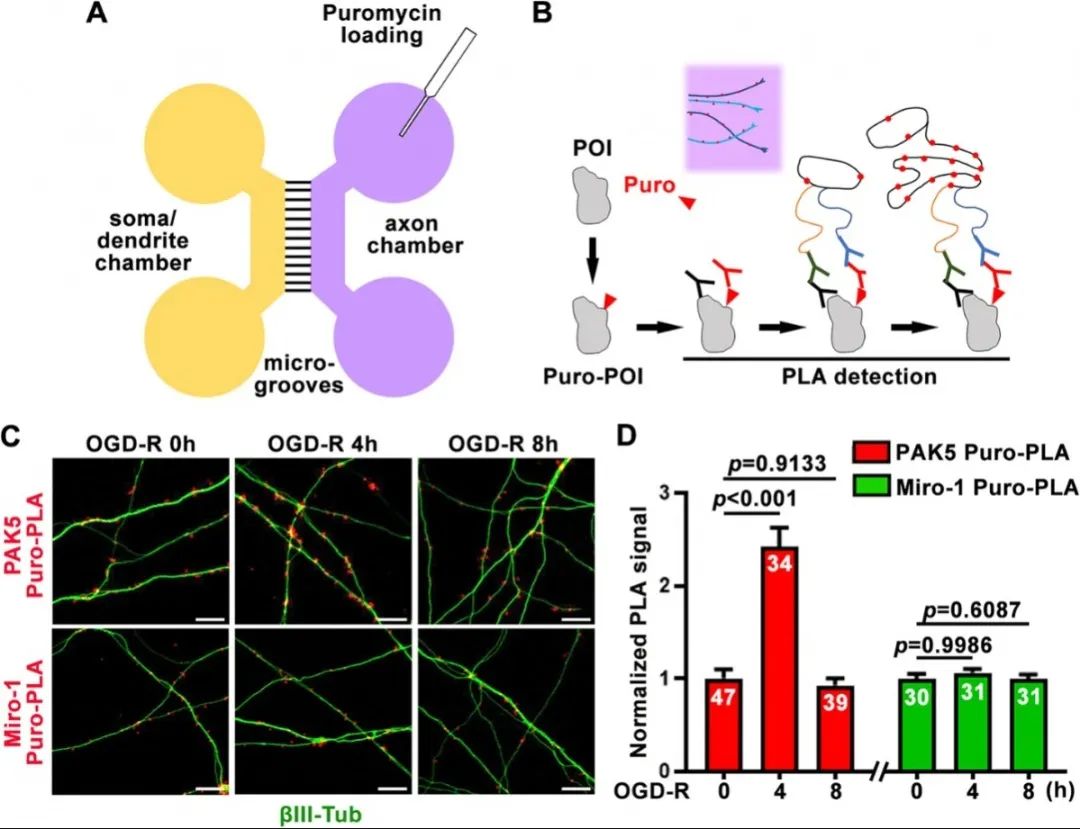
使用Puro-PLA技術原位監測神經元損傷后軸突中蛋白合成的動態變化
綜上所述,與中樞神經系統的體內損傷模型相比,借助微流控芯片裝置建立的體外損傷模型易于實現、重復性高,并且可以結合活細胞成像實時觀察受損神經元中的動態變化。通過高內涵成像技術,損傷軸突中的線粒體運輸以及能量代謝可以作為神經損傷修復相關藥物篩選的重要指標。
審核編輯:郭婷
-
芯片
+關注
關注
456文章
50889瀏覽量
424304
原文標題:微流控芯片+活細胞成像,用于神經元軸突損傷機制研究
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
活細胞的“聚光燈”——前沿活細胞成像的案例分享





 微流控芯片裝置與活細胞動態觀察技術用于神經元軸突損傷機制研究
微流控芯片裝置與活細胞動態觀察技術用于神經元軸突損傷機制研究










評論