循環腫瘤細胞(CTCs)是腫瘤診斷和監測的重要生物標志物。然而,因為它們的稀有性,CTCs的檢測仍然具有挑戰性,大多數的檢測方法都因CTCs在預富集步驟的丟失和缺乏捕獲不同類型癌細胞的通用抗體而受到限制。目前,CTCs分析通常基于兩步工作流程,包括CTCs富集和CTCs檢測。在富集過程中,血液中的CTCs可通過物理性質或者生化性質被捕獲。細胞的物理性質如大小、電荷或彈性可被用于富集CTCs。物理富集方法雖然有效,但往往復雜,并且不能避免CTCs的丟失。此外,物理富集過程中處理時間長、液體流速高也可能破壞細胞膜的完整性,影響CTCs的下游分析。另一方面,生物化學方法可以通過靶向腫瘤特異性標記物的抗體,例如細胞角蛋白(CK)、上皮細胞粘附分子(EpCAM)、表皮生長因子受體(EGFR)、人表皮生長因子受體-2(HER-2)等,直接分離和檢測CTCs。然而,由于癌細胞的異質性,其表面缺乏通用抗原,大多數基于免疫親和性的方法僅限于特定的癌癥類型或亞型,特別是轉移相關的間質型CTCs,很難被常用抗體檢測到。因此,需要迫切開發出適用于廣譜癌癥類型和亞型的高敏感和特異性的CTCs檢測方法,以適應CTCs的臨床應用。
據麥姆斯咨詢報道,近期,香港城市大學楊夢甦教授課題組聯合深圳灣實驗室崔淼博士報道了一種包含動態配體的雙重刺激響應單鏈納米鎖(SCNL)聚合物探針,它具有高靈敏度和選擇性,可以與過表達唾液酸(SA)的廣譜腫瘤細胞和CTCs結合。這種高靈敏度是通過聚合物的單鏈結構和多價功能基團實現的,提高了靶細胞與SCNL之間相互作用的可及性和結合穩定性。腫瘤細胞的靶向高選擇性是通過動態和雙重刺激響應的納米鎖結構實現的,它可以在同時暴露于過表達的SA和腫瘤酸性微環境中解鎖并功能化。除了用于CTCs計數,SCNL方法還可以通過監測腫瘤細胞表面SA的表達水平,來實現針對腫瘤細胞轉移能力的評估。
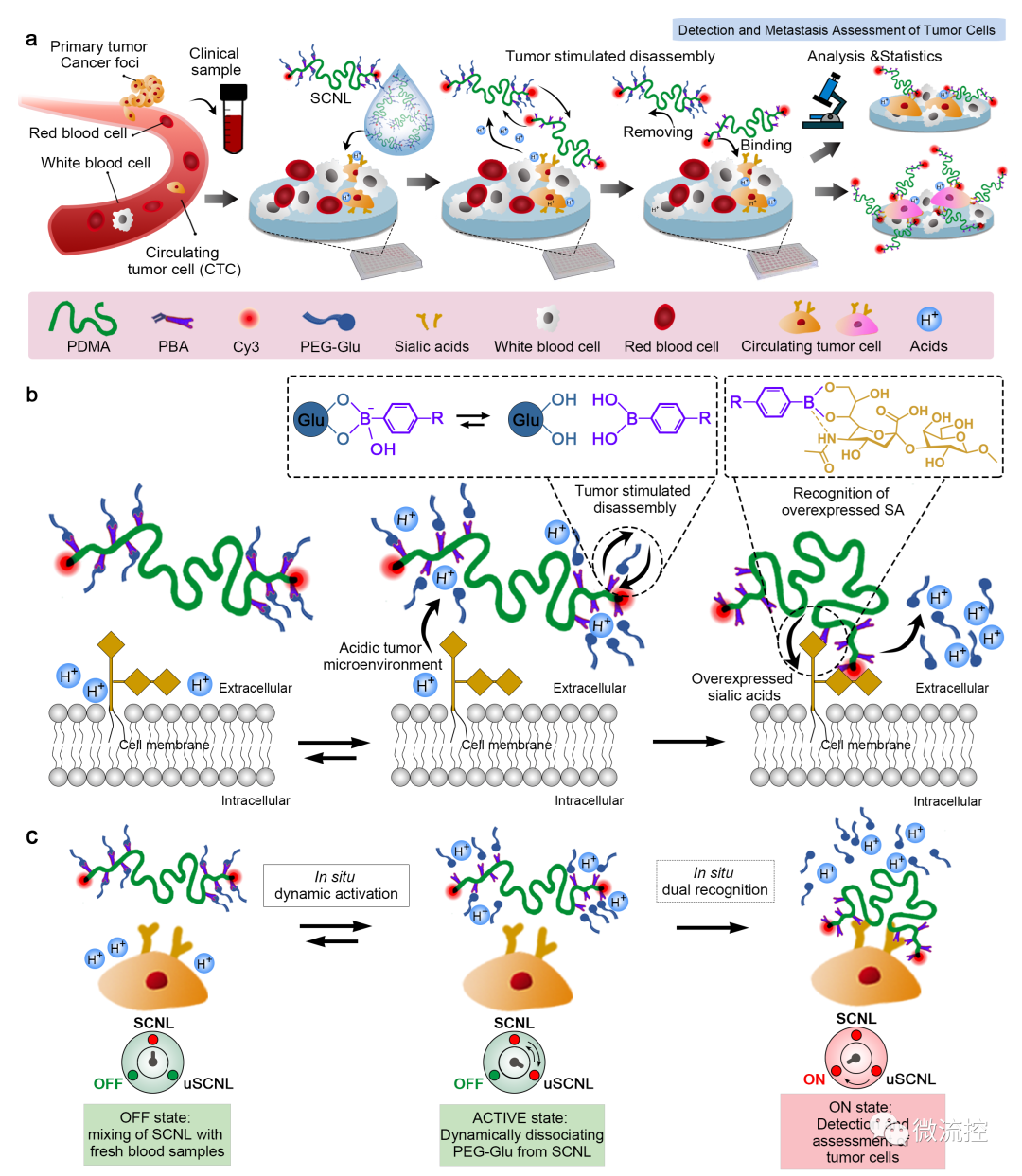
功能化單鏈納米鎖(SCNL)直接檢測腫瘤細胞和評估癌癥轉移的原理示意圖(來源:Biosens. Bioelectron.)
具體來看,這項研究采用動態結合策略,設計了一種具有鎖結構的功能化單鏈納米探針,可在酸性微環境及過量表達的唾液酸(SA)雙重刺激下動態打開并與腫瘤細胞相結合。當SCNL遇到腫瘤細胞時,腫瘤細胞周圍的酸性微環境會刺激嵌段單鏈聚合物(block single chain polymer)與PEG-Glu保護基團之間的預結合解離,因此保證了SCNL對腫瘤細胞的檢測特異性。在酸性微環境下解鎖后,由于SCNL上的苯硼酸官能團(PBA)可與SA同時形成共價鍵和配位鍵,與葡萄糖相比,解鎖后的SCNL(uSCNL)會主要與腫瘤細胞表面過表達的SA分子結合。此外,保護基團上的PEG片段也有助于減少單核吞噬細胞對SCNL的識別和吸收,從而進一步提高了腫瘤細胞檢測的特異性。綜上,柔軟的單鏈鎖結構有利于SCNL對腫瘤細胞的逐步協同識別。這種單鏈層面上的分級識別進一步保證了SCNL與CTCs之間的結合效率和準確性。
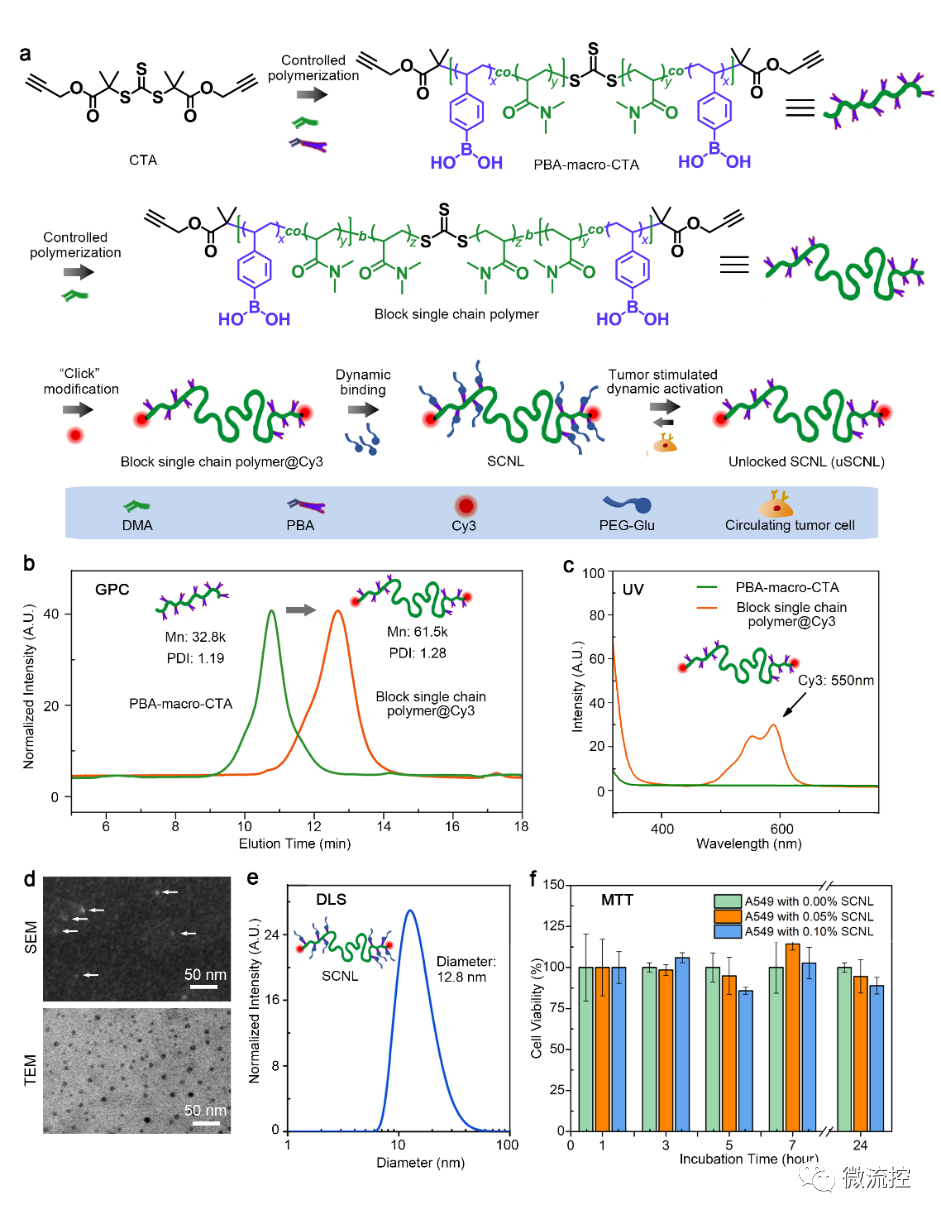
功能化單鏈納米鎖(SCNL)的制備與表征
(來源:Biosens. Bioelectron.)
本項研究以S,S ‘-雙(ɑ’ɑ‘-二甲基-ɑ“-醋酸丙炔基)三硫代碳酸酯(BDPT)為對稱鏈轉移劑(CTA),通過催化可逆加成斷裂鏈轉移(RAFT)聚合反應生成ABA型嵌段單鏈聚合物。首先將N,N-二甲基丙烯酰胺(DMA)與丙烯酸-苯基硼酸(acrylate-PBA)共聚形成PBA-大分子CTA(PBA-macro-CTA)作為第一個A嵌段。A嵌段中的共聚丙烯酸酯-PBA促進了單個聚合物鏈上多價PBA官能團的形成,與使用單價PBA修飾方法相比,可以顯著提高單鏈納米凝膠探針與癌細胞的結合親和性。在第二步B嵌段的聚合中,DMA被引入做為單體并進行聚合,為兩端鏈尾端帶有PBA官能團的A嵌段增加一個柔軟靈活的連接部分。中間polyDMA嵌段的靈活性可以有效地促進功能性PBA基團向癌細胞表面的唾液酸(SA)基團呈遞,最終促成癌細胞與嵌段單鏈聚合物的結合。以上得到的嵌段單鏈聚合物會繼續用Cyanine 3(Cy3)熒光基團進行標記,并與聚乙二醇修飾的葡萄糖保護基團結合形成最終的工作探針SCNL。工作探針SCNL的制備過程,結構和性質是通過凝膠滲透色譜、紫外吸收光譜、核磁共振(1H NMR)、掃描電子顯微鏡(SEM)、透射電子顯微鏡(TEM)、動態光散射(DLS)及細胞毒性實驗(MTT)來進行驗證的。
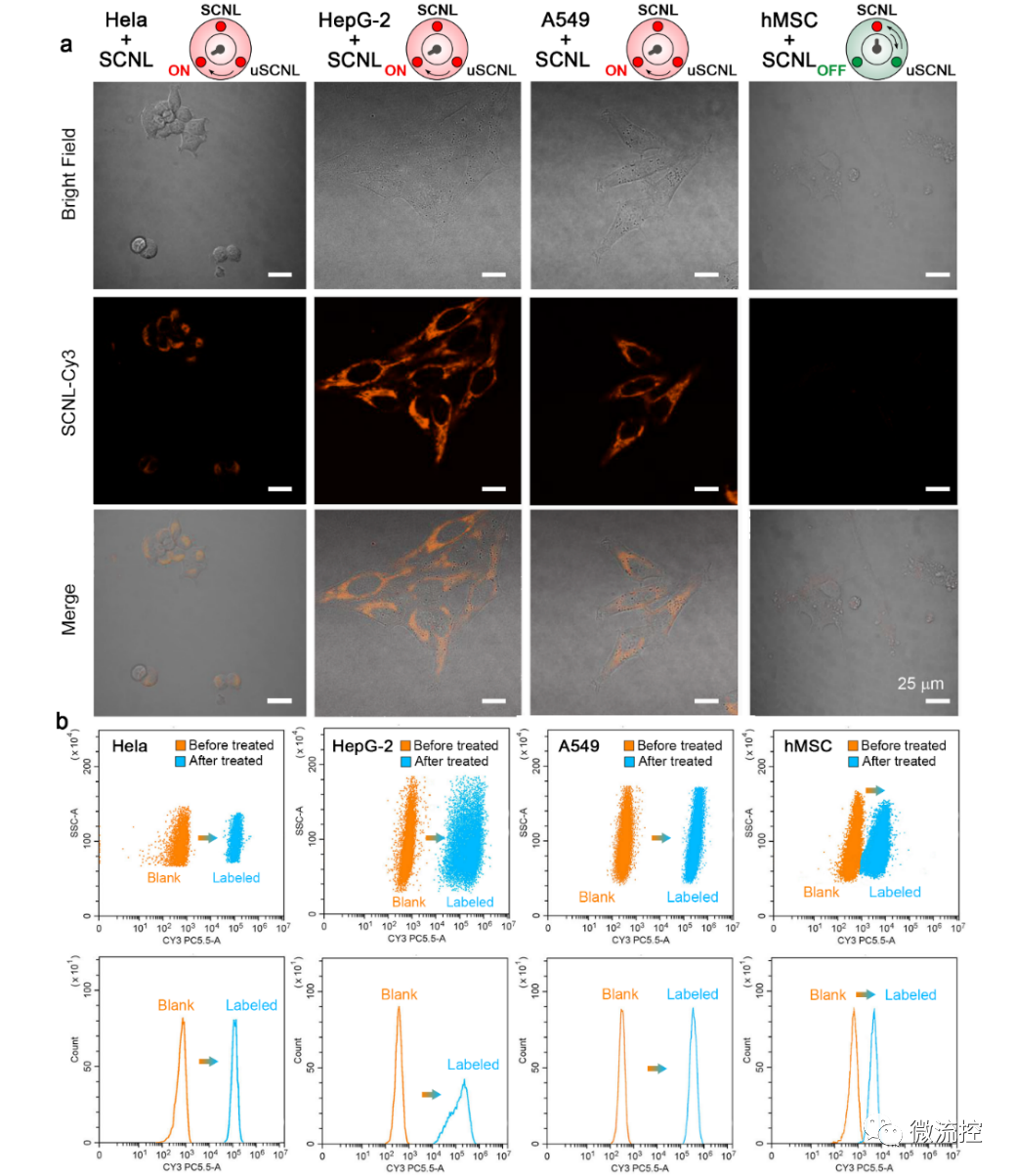
功能化單鏈納米鎖(SCNL)用于檢測不同類型的腫瘤細胞(來源:Biosens. Bioelectron.)
研究首先使用Cy3標記的SCNL來鑒別不同SA表達水平的Hela細胞、HepG-2細胞和A549細胞與正常對照細胞間的信號差異。從共聚焦激光掃描顯微鏡(CLSM)的結果來看,三種癌細胞經SCNL探針孵育后,細胞膜上的熒光強度均顯著增加。SCNL孵育后的Hela細胞信號的顯著增加表明,與之前報道的其他基于PBA的探針相比,SCNL探針具有更高的靈敏度和標記效率。此外,研究繼續利用流式細胞術和熒光顯微鏡技術證實了SCNL探針對Hela、HepG-2、A549、H1299、H4006、MDA-MB-231和MCF-7細胞系的靶向能力,進一步驗證了SCNL檢測不同類型腫瘤的普遍適用性。
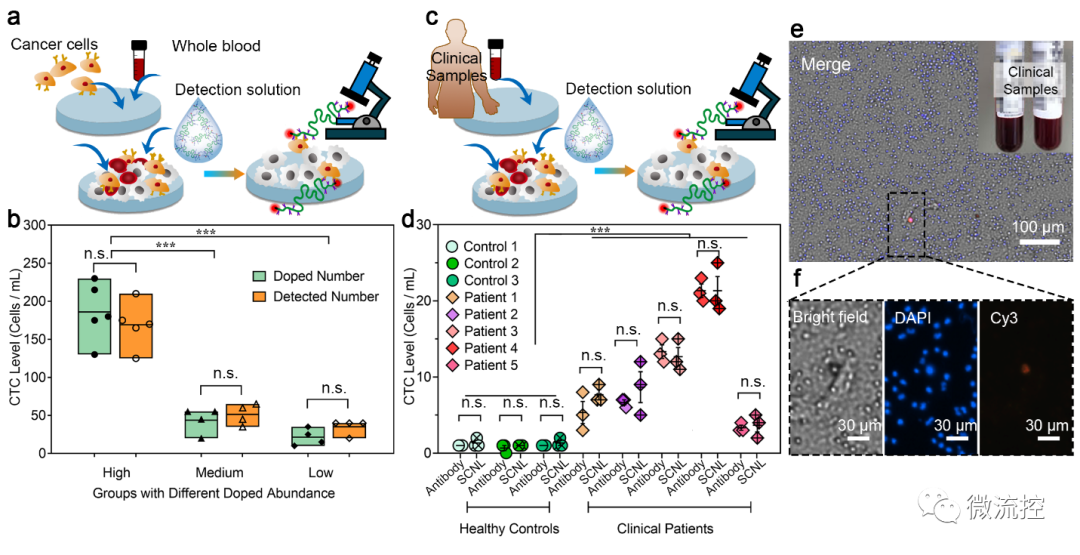
功能化單鏈納米鎖(SCNL)用于檢測模擬樣本和臨床樣品中的CTCs(來源:Biosens. Bioelectron.)
而后,研究進一步將該方法應用于3例健康人和5例非小細胞肺癌患者的臨床樣本CTCs檢測中。其中,健康人群的血液樣本中只檢測到極低的CTCs水平(《3 CTCs/mL)。但所有5例患者的樣本均檢測到具有顯著個數的CTCs,這證實了SCNL探針的樣本高檢出率。為了進一步驗證檢測方法的準確性,研究將同一個人的血液樣本中基于SCNL的CTCs的檢測結果與基于EpCAM抗體和CD-45抗體的免疫熒光染色方法的檢測結果進行了比較。抗體法和SCNL探針法檢測到的CTCs數量水平相似,驗證了SCNL探針在CTCs臨床樣本檢測中的準確性和適用性。
綜上所述,該研究開發了一種基于SCNL的方法,用于特異性結合和檢測表面過表達SA分子的癌細胞。通過識別癌細胞周圍的酸性微環境和癌細胞表面過表達的SA分子,動態PEG-Glu保護基團和PBA-SA識別機制保證了SCNL探針對癌細胞的特異性靶向作用。其設計原理和結合機制使功能化SCNL探針對CTCs具有較高的檢出率。由于SCNL探針在癌細胞表面具有較高的穩定性、靈活性和標記密度,對于SA表達相對較低的Hela細胞,SCNL方法也表現出較高的敏感性和選擇性。同時,SCNL探針還顯示出對癌細胞轉移風險進行評估的潛能來預測腫瘤的惡性程度。該方法可與微流控技術相結合,實現高通量和床旁檢測,以滿足精準醫療的要求。此外,這項工作還可能激發新一代單鏈納米探針的開發,用于如癌癥轉移和其他糖蛋白相關疾病的臨床檢測。
-
納米
+關注
關注
2文章
698瀏覽量
37052 -
細胞
+關注
關注
0文章
66瀏覽量
18355
原文標題:包含動態配體的雙重刺激響應單鏈納米鎖聚合物探針,用于循環腫瘤細胞高敏檢測
文章出處:【微信號:MEMSensor,微信公眾號:MEMS】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
白介素ELISA檢測試劑盒信息
BIAcore-生物分子相互作用分析儀原理和操作注意事項
研究團隊發現石墨烯一重要作用:可分辨普通細胞與癌細胞
WLCSP封裝在機械性能方面的特異性
新型追蹤篩查系統有望靶向殺滅腫瘤細胞
CTC的富集和分析方法
應用轉基因檢測試劑盒時需要注意的事項有哪些
細菌檢測儀的檢測原理
表面潔凈度檢測儀的特性及參數
表面潔凈度檢測儀的應用、特性及參數
用于單分子無標記定量檢測的數字膠體增強拉曼光譜技術





 基于SCNL的方法用于特異性結合和檢測表面過表達SA分子的癌細胞
基于SCNL的方法用于特異性結合和檢測表面過表達SA分子的癌細胞










評論