胰腺導管腺癌(PDAC)占源胰腺癌癥的93%。PDAC被認為是所有癌癥中最致命的,并且預后極差。PDAC患者總體上表現出高度的分子腫瘤異質性,使治療復雜化,并阻礙了臨床試驗的成功。
目前的體外技術不能充分復制PDAC腫瘤微環境(TMEs)中復雜的基質成分,也不能模擬給定腫瘤的獨特遺傳表型。因此目前迫切需要開發一種利用腫瘤相關信息預測藥物反應的個性化治療方法。
鑒于此,美國芝加哥拉什大學Faraz Bishehsari教授團隊開發了一種腫瘤芯片裝置,通過結合患者衍生類器官(PDOs)和基質細胞,特別是胰腺星狀細胞(PSCs)和巨噬細胞(U937),成功建立了一個復雜的包含纖維增生間質和免疫細胞的腫瘤環境,延長了PDOs細胞功能和壽命,且證明了靶向基質導致對癌細胞的化療效果顯著增加,從而驗證了該腫瘤芯片裝置用于藥物測試的可行性。
首先,研究人員通過細針活檢(FNB)收集PDAC患者的活檢樣本,經過培養使其在3D基質膠環境中形成球形類器官。
H&E和上皮細胞粘附分子(EpCAM)染色實驗驗證了類器官細胞與原始組織在結構和功能上的一致性。將基質細胞(PSCs和U937)和類器官共培養,U937和類器官發生雙向誘導增殖,且類器官平均直徑均明顯大于單獨培養時,免疫熒光成像顯示PSCs分泌了更多的膠原蛋白。
并且在MIA PaCa-2細胞(一種胰腺細胞系)中也觀察到癌細胞和U937細胞在共培養時的雙向增殖效應。
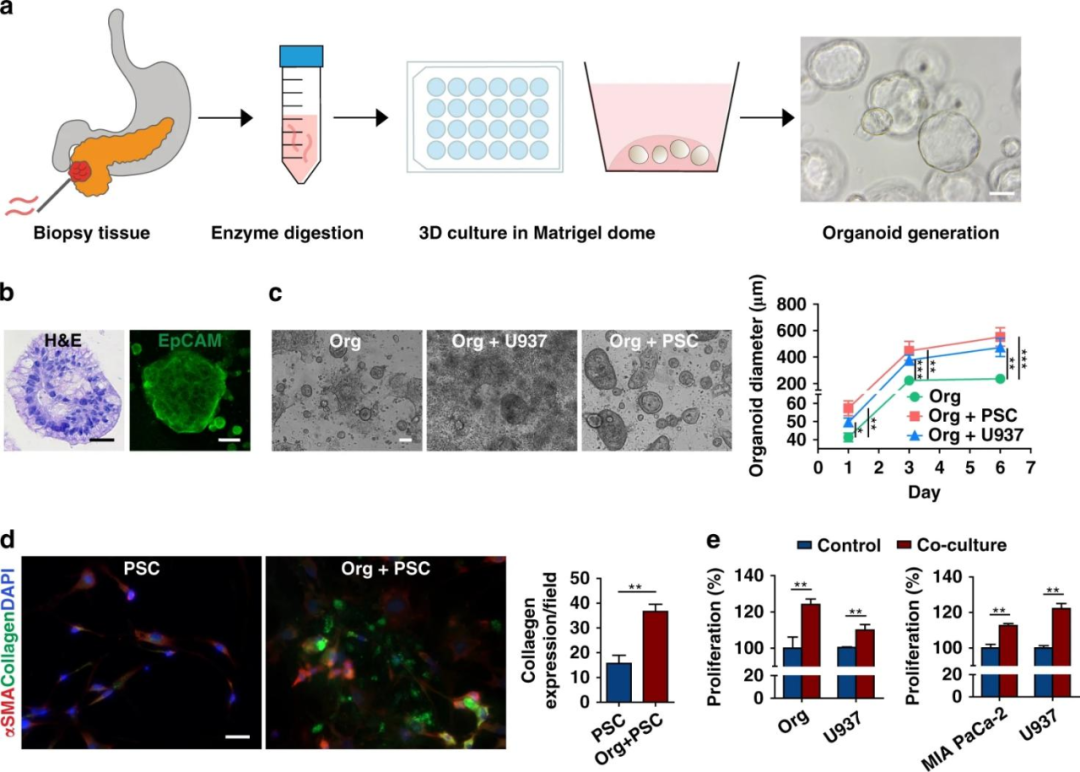
圖1 患者來源的類器官(PDOs)的增殖特性,以及與基質細胞的雙向促進作用
腫瘤細胞的侵襲性實驗顯示PCCs在與基質細胞共培養時遷移的距離更大,同時H&E和EpCAM染色證實了遷移的細胞是PCCs。該實驗表明共培養時基質細胞能誘導PCCs的侵襲性。
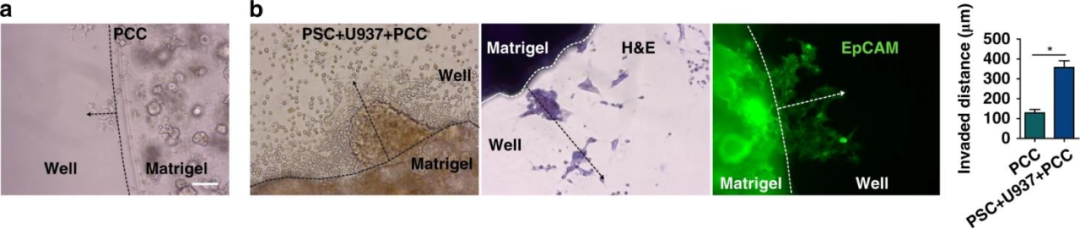
圖2 基質細胞增加了癌變上皮細胞(PDOs)的侵襲性
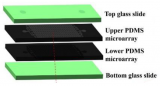
該微流控芯片由兩個被多孔膜隔開的腔室組成,從上部腔室的入口裝載細胞,下層的腔室入口通過導管與含有培養基(有機類培養基∶RPMI=1∶1)的注射器相連,注射器與泵相連以5ul/h的流速持續灌注介質。為了觀察PCCs的生長情況,將2000個類器官懸浮于50%基質膠中,載入每個芯片的上腔室,培養1周后,類器官從球形轉化為二維(2D)結構,這些細胞被稱為PCCs。
PCCs在16天內占據了該室的整個內部空間。最初,類有機物由基質凝膠支撐,以保持芯片中的3D球形結構,但最終轉變成2D層,這可能是基質膠降解的結果。
接下來研究人員進行了活-死生存實驗證明了芯片表明2D細胞的存活,同時癌變上皮細胞膜中EpCAM和pERK的表達水平也表明了細胞存活和生長。隨后的共培養和藥物治療研究實驗均在3D類器官仍存在的9天內進行。
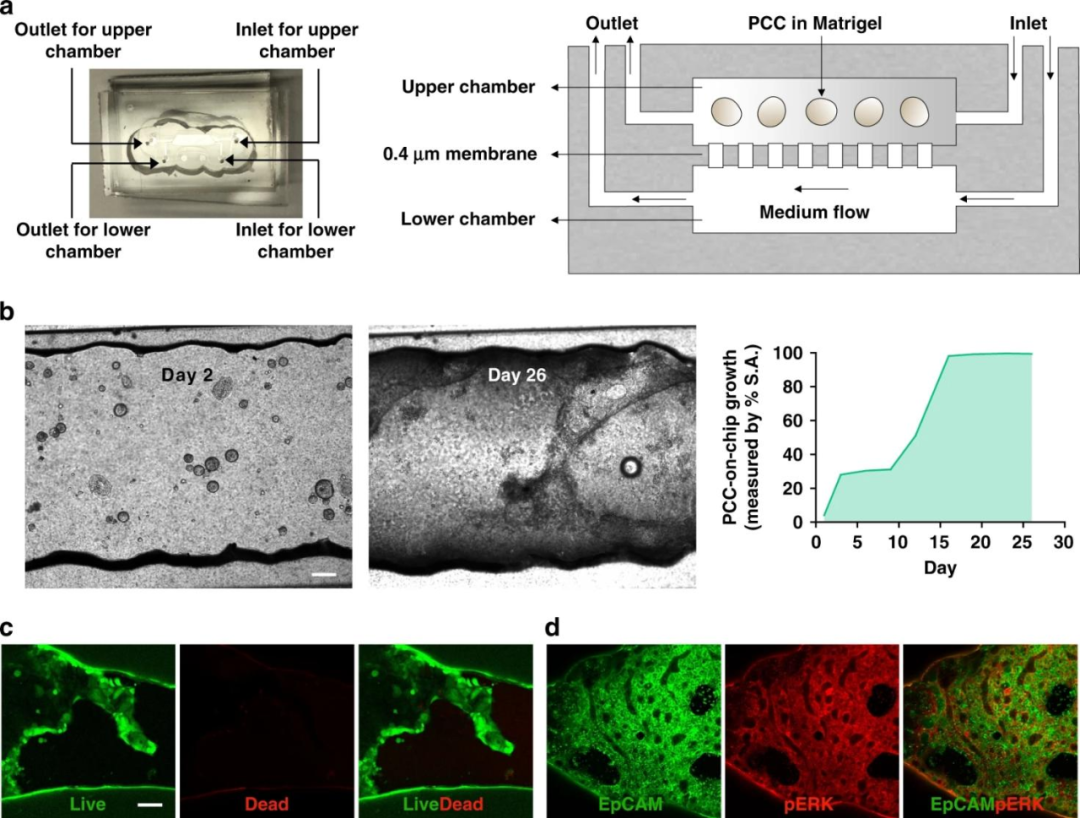
圖3 一種用于PDOs的培養和生長的雙室微流控芯片
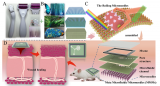
為了概括PDAC TME的特征,研究人員將基質細胞與PCCs結合,并將它們加載到芯片的上腔。在共培養6天里,PCCs生長并發生結締組織塑性反應。到第6天,基質細胞共培養芯片中的PCC生長明顯快于單獨培養時,占據了腔室空間的83.6%,證實了基質對芯片中PCC增殖的影響。
與芯片相比,細胞的平行多孔板共培養顯示出顯著較低的癌細胞生長,這進一步支持了使用芯片作為一個優越的平臺來再現癌細胞的旺盛生長。
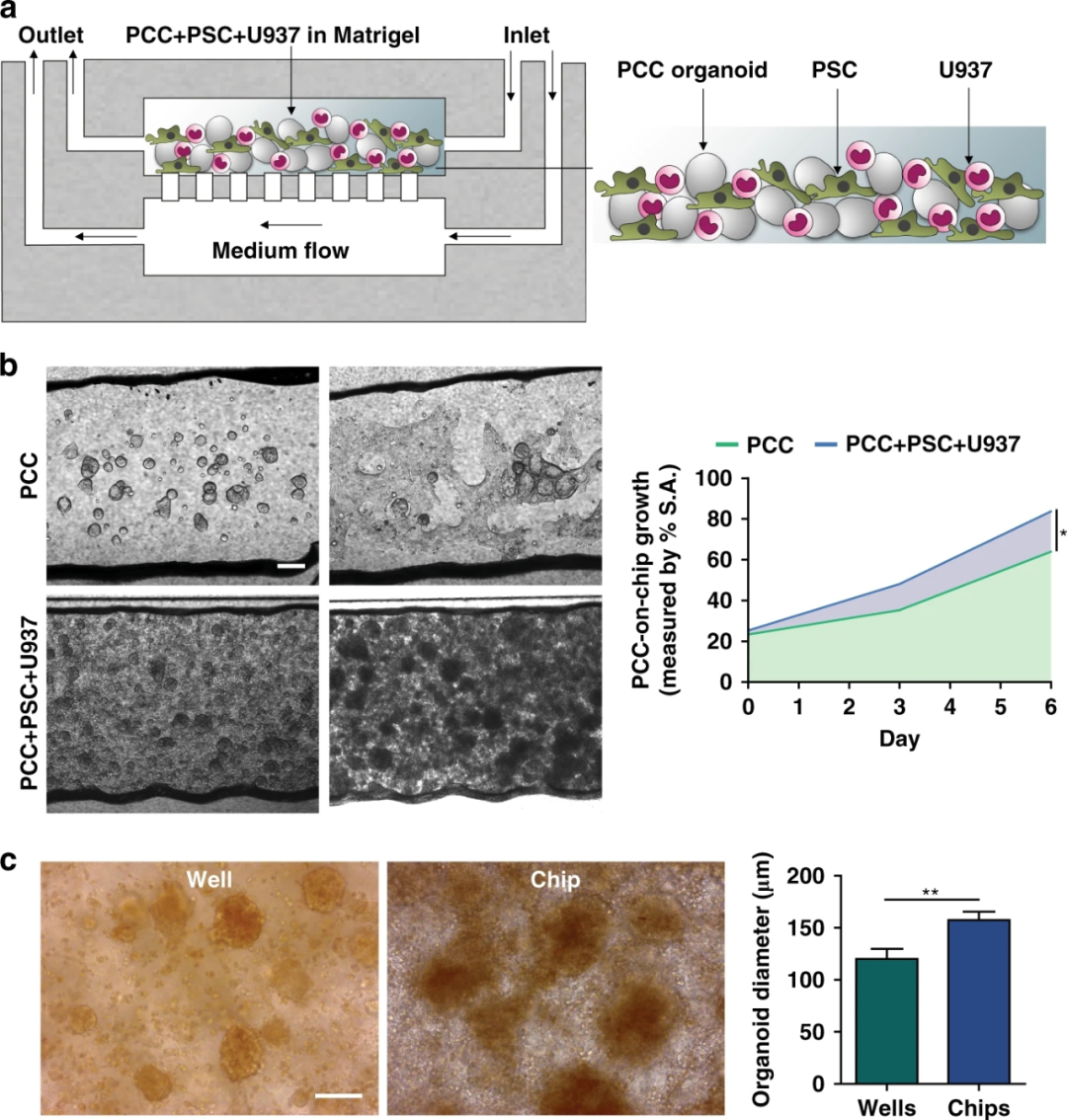
圖4 原發癌細胞(PCC)與基質細胞在芯片上的生長
明場成像和H&E染色顯示了PCCs與芯片中基質細胞的密切相互作用。U937細胞和PSCs中CD68和α-平滑肌肌動蛋白(α-SMA)的染色分別揭示了PCCs周圍基質細胞的存在。
同時幾種標記物在基因表達水平上進一步表征了共培養的PSCs和U937細胞。
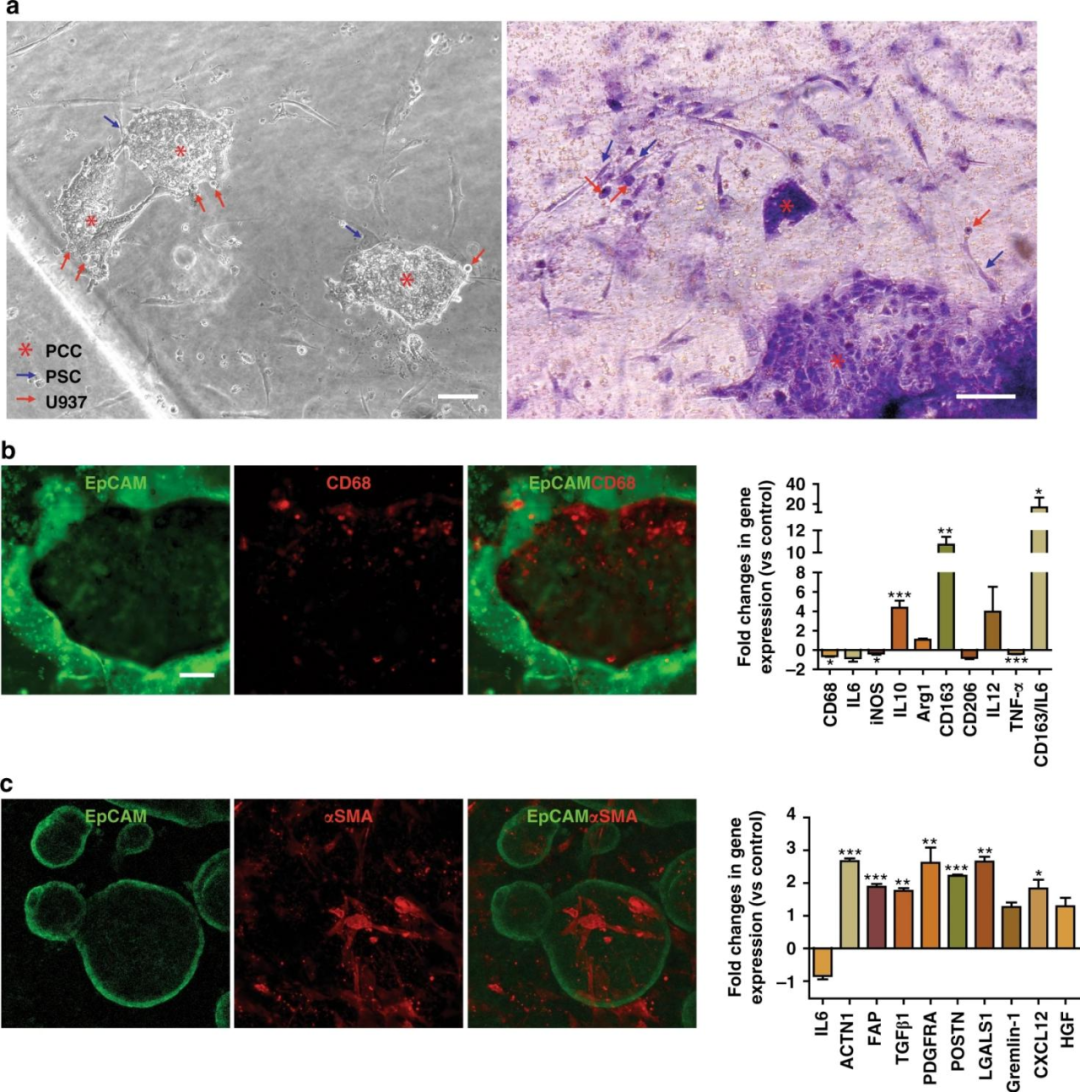
圖5 在芯片中PDAC TME的再現
為了表征芯片的藥物反應測試功能,研究人員首先分別在PSCs、U937細胞和類器官中測定了ATRA、Clodrosome和吉西他濱的IC50值。且實驗表明基質消耗劑的IC50值不影響PCCs或MIA PaCa-2細胞的存活力。
用來自一名患者的類器官考查PCCs的體外藥物反應,將細胞與基質細胞一起接種到芯片中,培養6天后,將吉西他濱或吉西他濱與ATRA和Clodrosome以其IC50值灌注芯片72h,然后在第9天PFA固定和染色,與未經治療相比,吉西他濱誘導的PCC Caspase-3表達可評估顯著的PCC凋亡。結果顯示,在腫瘤芯片模型中,TME調節劑對化療的抗腫瘤療效有增強作用。
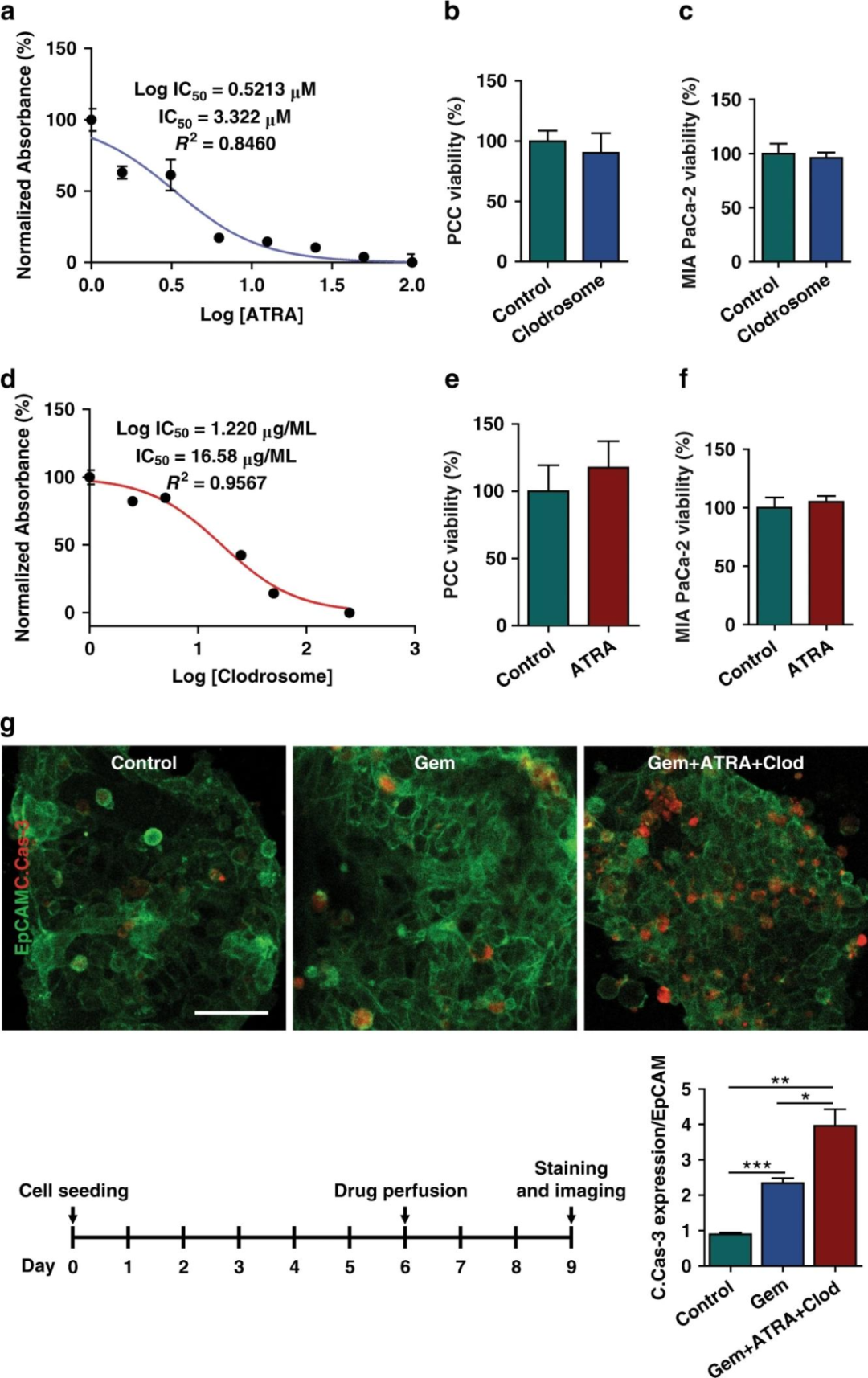
圖6 基質消耗在化療反應中的影響
在這項研究中,研究人員開發了一種最先進的多細胞組織芯片模型,該模型顯示了原代PDOs長期細胞存活率的提高,證實了基質細胞在PDAC惡化中的顯著影響,以及癌性上皮細胞通過膠原沉積和癌癥相關基因表達劫持基質細胞功能以創造有利TME的能力。
PDOs和基質細胞在微流控芯片裝置中的共培養可再現特定患者的TME,因此可用于在臨床應用前在實驗室中評估任何抗癌藥物的敏感性。最后,可通過提供所需的技術數據來設計可以優化藥物反應的生物測定工具,從而推進PDAC個性化/精準醫療的實施。
論文鏈接:
https://doi.org/10.1038/s41378-022-00370-6
審核編輯:劉清
-
微流控芯片
+關注
關注
13文章
277瀏覽量
18872 -
pcc
+關注
關注
0文章
26瀏覽量
24532 -
RPM
+關注
關注
0文章
45瀏覽量
17726
原文標題:雙室微流控芯片用于再現?胰腺導管腺癌微環境
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦




 淺析雙室微流控芯片用于再現?胰腺導管腺癌微環境
淺析雙室微流控芯片用于再現?胰腺導管腺癌微環境











評論