高通量篩選技術已經成為合成生物學等領域中突變體酶、突變體菌株篩選過程中不可或缺的技術,其應用前景廣闊。目前,高通量篩選方法所需儀器主要依賴流式細胞儀、液滴微流控等,這些技術可以實現突變體庫的超高通量篩選。但是,目前對于很多待分析物,仍缺乏直接的高通量篩選方法。
據麥姆斯咨詢報道,為解決上述難題,近日,Biosensors and Bioelectronics在線發表了江南大學未來食品科學中心和生物工程學院陳堅院士團隊劉龍教授課題組的研究成果“Directed evolution of diacetylchitobiose deacetylase via high-throughput droplet sorting with a novel, bacteria-based biosensor” 。該研究首先構建了一種響應氨基葡萄糖(GlcN)濃度的生物傳感器;接著,將其與液滴微流控高通量篩選技術結合構建GlcN的高通量篩選方法。并且,以產生GlcN的關鍵酶—己丁二糖脫乙酰酶(Dac)突變體庫的篩選為例,對所構建的篩選方法進行了驗證,實現了液滴內Dac酶活性的高通量檢測,顯著提升了Dac的酶活性(圖1)。
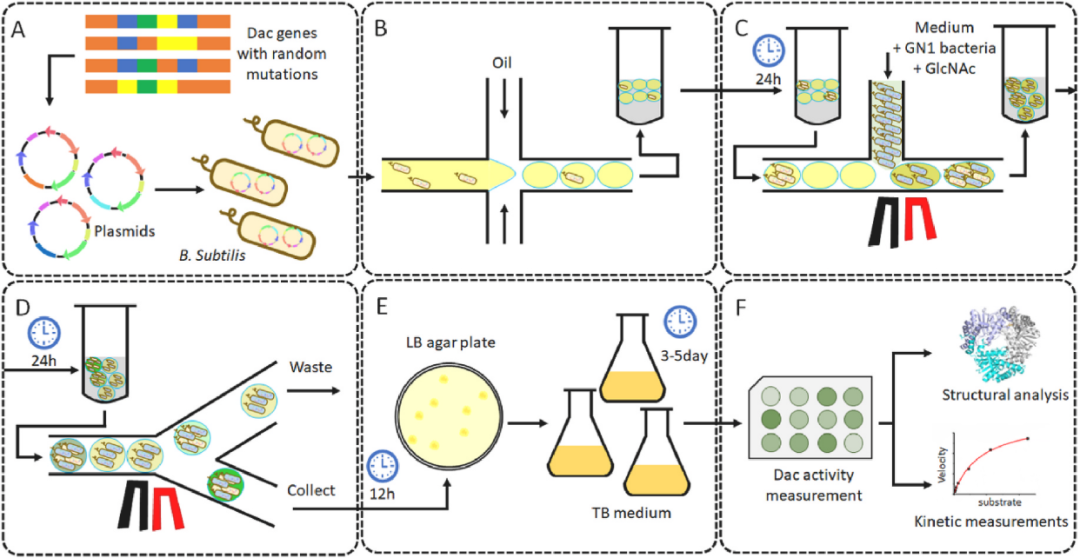
圖1 結合生物傳感器與液滴微流控篩選Dac突變體酶示意圖
構建響應氨基葡萄糖的生物傳感器
該研究設計構建了一種可以響應GlcN濃度的生物傳感器,該生物傳感器可以將GlcN的濃度轉化為綠色熒光信號,其熒光表達強度與GlcN濃度正相關,進一步可以指示關鍵酶Dac的酶活水平。
首先,在孔板體培養系中,通過添加不同濃度的GlcN,驗證了檢測菌GN1(包含有生物傳感器)對GlcN的響應情況,證實了其可在適當范圍內(0-1.5g/L)線性響應GlcN的濃度,且不會被底物乙酰氨基葡萄糖(GlcNAc)干擾。并且,利用表達不同Dac突變體(酶活性不同)的菌株(M0-無酶活、M1-低酶活、M2-高酶活)模擬了突變體酶的篩選過程。結果表明,含有傳感器的檢測菌株,可以通過熒光表達強度的高低,區分出酶活性的高低,證實了所構建的篩選方法在實際的突變體庫篩選過程中的可行性。
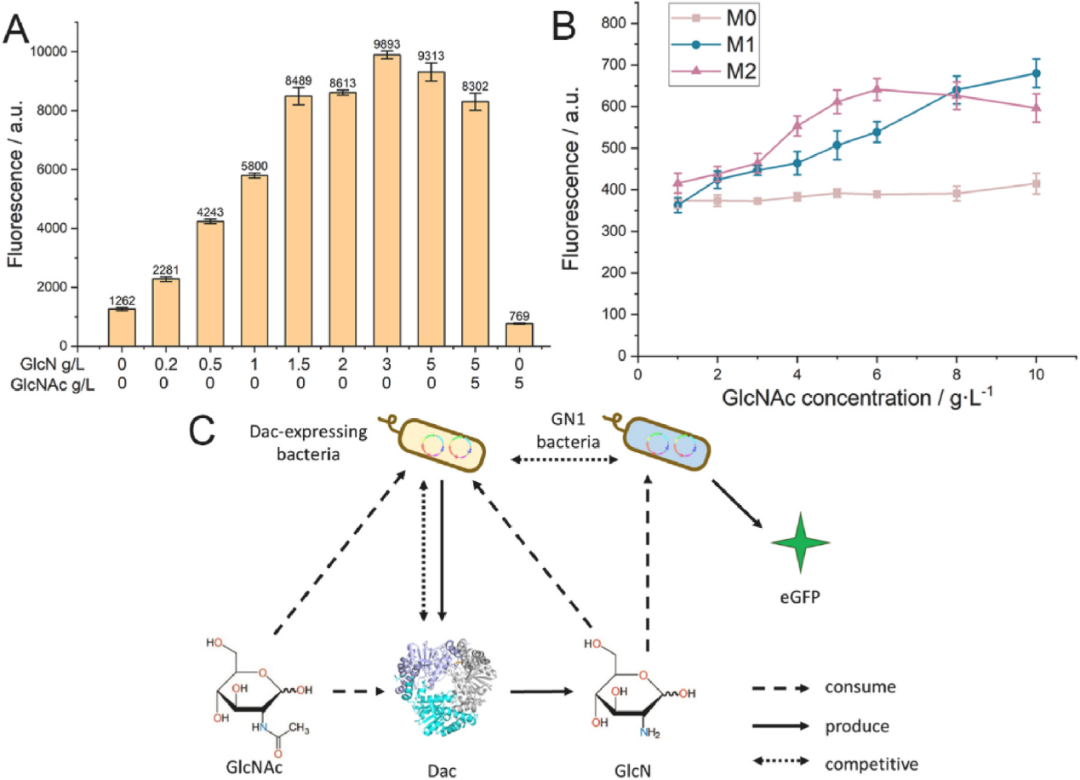
圖2 孔板體系中生物傳感器對GlcN濃度、Dac酶活性的響應情況
液滴體系下傳感器的驗證
孔板中驗證了篩選方法的可行性后,進行下一步的液滴分選實驗。按照1:1的比例,將表達Dac的菌株與含有生物傳感器的檢測菌株GN1混合培養,接著進行液滴分選。圖3A顯示了各種液滴的平均熒光強度,熒光強度與GlcN的濃度呈正相關。為了驗證Dac在液滴中能否正常表達、發揮活性,分別將表達Dac突變體M0、M1和M2的菌株封裝在液滴中,孵育24小時,并加入GN1檢測菌株和底物GlcNAc,進行熒光信號的表征。如圖3B所示,菌株M0、M1和M2的熒光信號分別為886.9 ± 79.4、1396.7 ± 133.0和1820.5 ± 192.9。結果表明,所構建的GlcN生物傳感器同樣也適用于Dac突變體的高通量液滴分選。
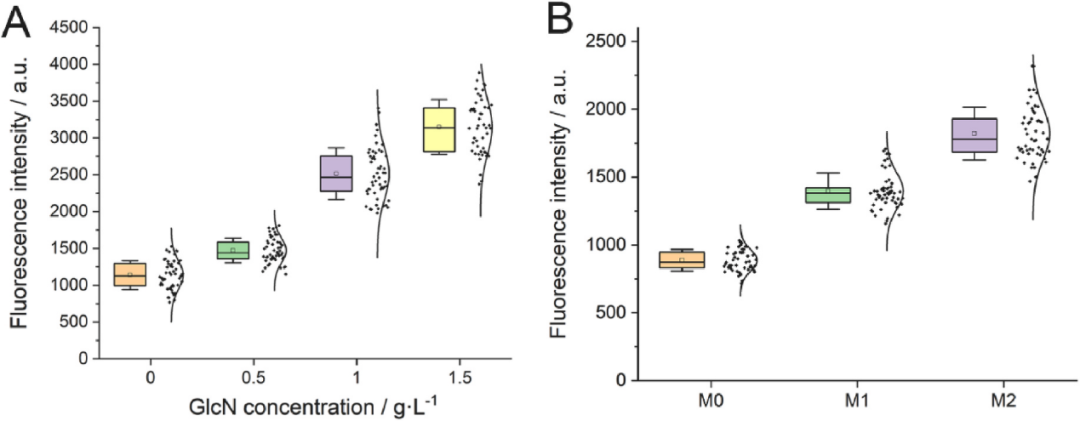
圖3 液滴體系中生物傳感器對GlcN濃度、Dac酶活性的響應情況
關鍵酶Dac的定向進化
首先通過易錯PCR技術,構建關鍵酶Dac的突變體文庫。隨后,利用建立的高通量篩選方法,對含有不同Dac突變體的菌株庫進行篩選,共篩選了約20萬個突變體;經復篩驗證,得到了最佳的突變體M7,其酶活由突變前的27.2 ± 1.8U/mL(M2)提升至48.6 ± 1.5U/mL(圖4)。
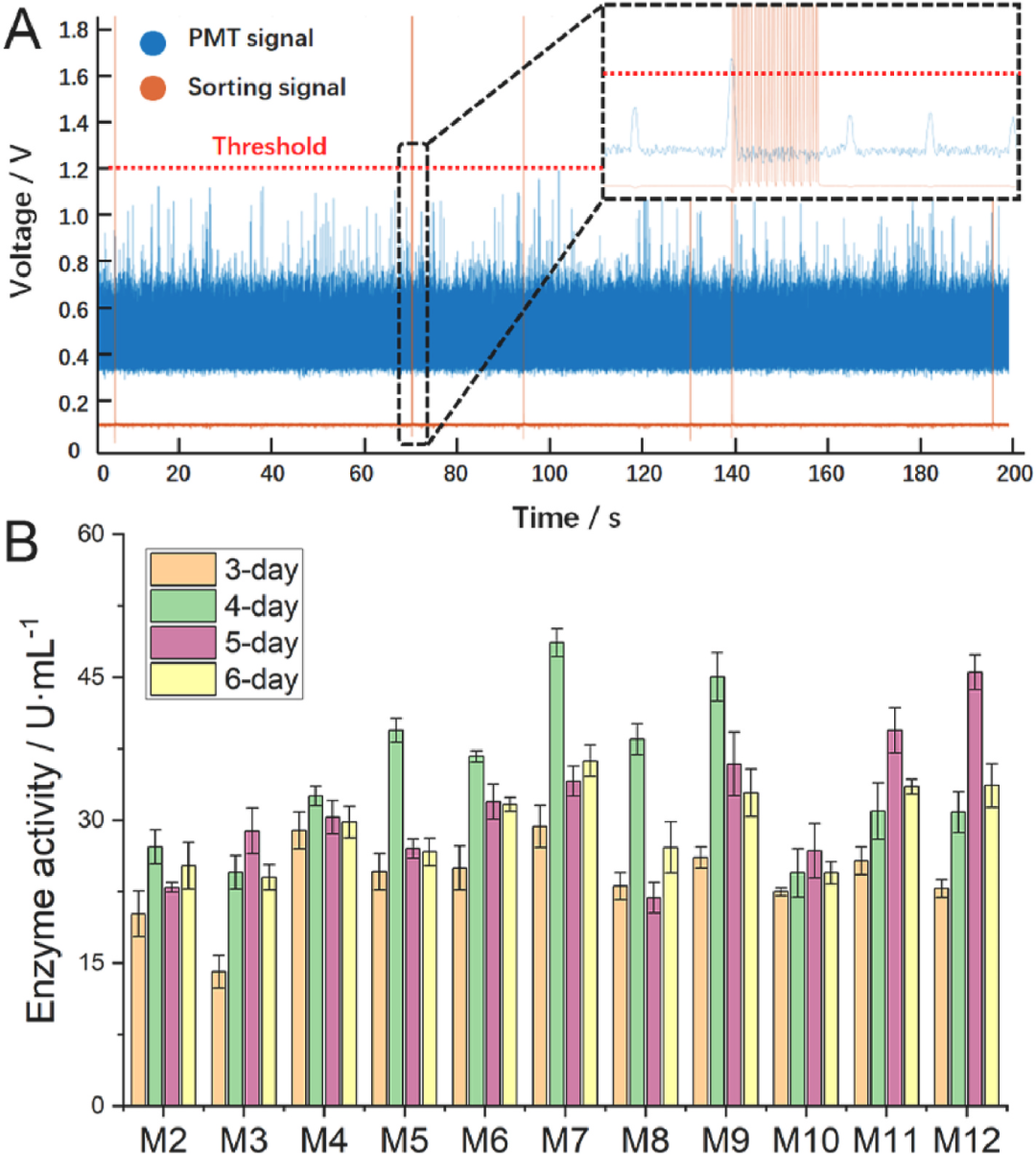
圖4 篩選閾值設定與酶活水平檢測
突變體的表征
通過測定M2和M7的動力學常數Km和Vmax。如圖5A和B所示,M7的Vmax(755.9 ± 24.0μm/s)是M2(368.8 ± 19.2μm/s)的兩倍,這與M7酶活性增強的結果一致。根據突變位點分析,M7在M2(R157T)的基礎上增加了S60I和F168S突變點,進一步提升了酶活。
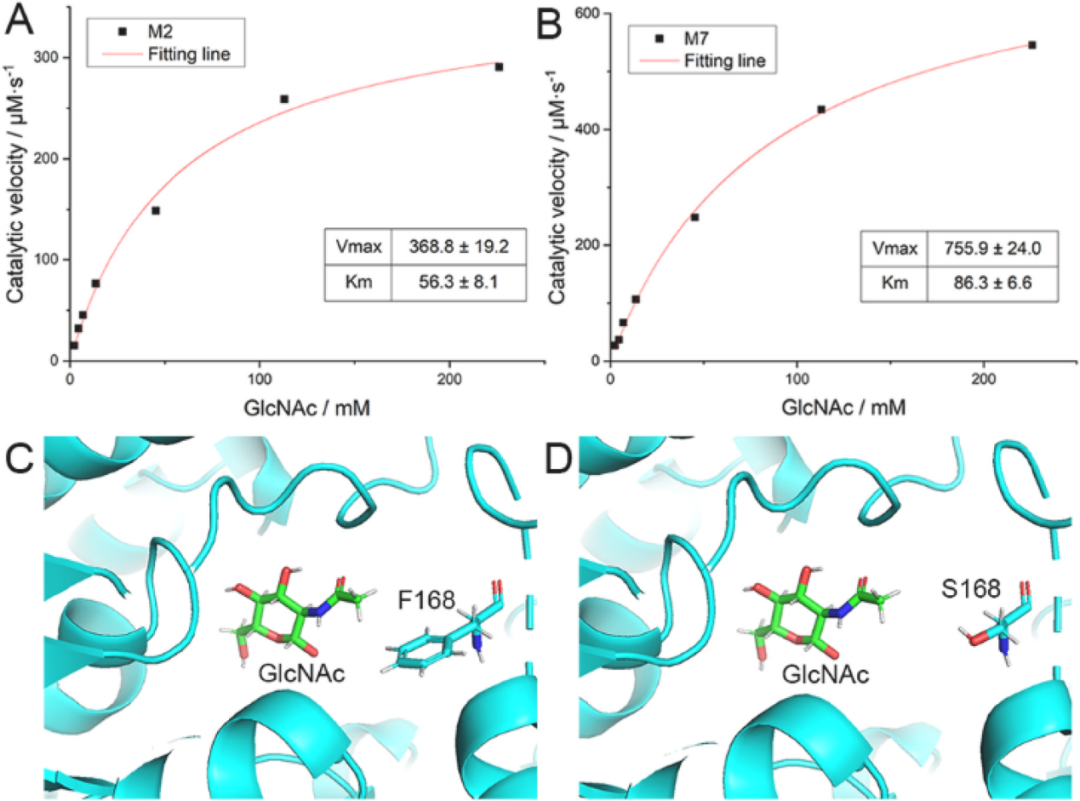
圖5 最佳Dac突變M7與突變前(M2)的比較
綜上所述,該研究開發了一種新型生物傳感器,將GlcN濃度與綠色熒光信號相關聯,并將其應用于GlcN合成關鍵酶Dac的定向進化。結合高通量液滴分選系統,成功獲得了酶活比原始突變體提高了1.8倍的Dac突變體。生物傳感器與高通量液滴分選系統在Dac定向進化方面的成功應用,進一步助力了氨基葡萄糖的工業化生產。
論文鏈接:
https://pubmed.ncbi.nlm.nih.gov/36327560/
審核編輯 :李倩
-
傳感器
+關注
關注
2552文章
51331瀏覽量
755468 -
生物傳感器
+關注
關注
12文章
372瀏覽量
37421
原文標題:基于新型細菌生物傳感器的高通量液滴分選,實現Dac酶定向進化
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
沈陽農業大學:研究一種基于硼酸二醇識別的原位和體內檢測糖的新型電化學傳感器
寧波大學:通過電熱薄膜刺激汗液分泌的可穿戴生物傳感器,用于靜息狀態下汗液葡萄糖持續分析
生物傳感器:科技前沿的生物監測利器
高可調性材料:Haydale生物傳感器油墨,打造靈活定制化印刷解決方案
從糖尿病管理到環境監測:葡萄糖傳感器的多元應用探索
微針葡萄糖傳感器貼片 可至皮膚深層持續監測
MIT/三星研究人員利用活體拉曼光譜直接觀察葡萄糖指紋圖譜

Aigtek功率放大器如何幫助納米電子生物傳感器更好的研發和生產
電化學生物傳感器在生物檢測領域的顯著優勢
三郡科技:電化學生物傳感器電極與生物芯片的異同
便攜快速檢測的電化學生物傳感器:顛覆性變革生物檢測方式
用于原位監測汗液標志物的全打印、多模態可穿戴生物傳感器陣列




 一種響應氨基葡萄糖(GlcN)濃度的生物傳感器
一種響應氨基葡萄糖(GlcN)濃度的生物傳感器










評論