近年來,合成生物學的快速發展為腫瘤細菌療法的深度優化帶來新的契機。基于合成生物學手段,科學家們能夠利用基因工程改造的微生物或細胞而非傳統的化學小分子或生物制劑,作為新型疾病治療方法的開發基礎。人工設計的攜帶有合成基因線路的微生物或細胞能夠響應疾病標志物或者外界信號,實現對藥物釋放位置、釋放時間和釋放劑量的控制,已逐漸發展為人類對抗疾病的強有力武器。
在傳統的細菌改造基礎上,經過理性設計的基因通路賦予了底盤細菌更多樣化的治療能力,彌補了天然菌株在腫瘤治療方面的缺陷,腫瘤細菌療法也因此成為極富應用前景的新型腫瘤療法。現有腫瘤細菌療法的優化策略主要集中在新型藥物的應用、新型可控釋放方式的引入等,但是卻忽略了細菌自身行為對腫瘤治療效果的影響,缺乏對腫瘤治療過程中細菌行為的持續控制。腫瘤治療是一個長期的過程,可控持續的藥物釋放是提高腫瘤治療效果的關鍵,雖然在材料領域通過高分子水凝膠和脂質等已經實現了藥物的持續釋放,但是在腫瘤細菌療法中仍然是一個挑戰。
近日,中國科學院深圳先進技術研究院合成生物學研究所金帆課題組在國際學術期刊National Science Review上發表了題為“Programming the lifestyles of engineered bacteria for cancer therapy”的研究成果。通過合成生物學的設計,研究人員成功地將銅綠假單胞菌菌株改造成為具有實體瘤治療功效的工程菌。在治療過程中,該工程菌的全局表型可被近紅外光的輻照程序精確的控制,即:在弱定殖、定殖以及裂解釋藥三種表型切換,從而更有效地消融瘤體達到治療效果,具有巨大的潛在應用價值。深圳先進院合成所助理研究員張榮榮為論文共同第一作者及共同通訊作者,金帆研究員為文章通訊作者。
在自然界中,銅綠假單胞菌在有利的環境中處于浮游狀態,其在表面定殖的能力較弱;而在不利的環境中則會進入生物被膜狀態,其表面定殖能力大大增強。受到自然界中細菌生存方式的啟發,研究團隊為工程菌設計了浮游狀態和生物被膜狀態以實現對其定殖能力的控制,其中浮游狀態細菌的定殖能力較弱,能夠減少對正常組織的傷害;而生物被膜狀態細菌的定殖能力較強,能夠增加其在腫瘤組織內的定殖量。研究團隊通過敲除毒力因子調控蛋白編碼基因vfr和三型分泌系統相關基因exoS和exoT構建了減毒的銅綠假單胞菌菌株作為腫瘤細菌療法中的新型底盤菌株。銅綠假單胞菌在浮游狀態和生物被膜狀態兩種生活方式之間的切換與第二信使分子環二鳥苷酸(c-di-GMP)的濃度密切相關,為此,研究團隊使用兩個基因模塊對細菌胞內的c-di-GMP濃度進行控制,分別是:
1)通過組成型啟動子表達磷酸二酯酶PA2133以分解c-di-GMP,使細菌維持較低的胞內c-di-GMP水平,進入浮游狀態;
2)引入可在近紅外光照射下合成c-di-GMP的光敏蛋白BphS,近紅外光照射可使細菌胞內c-di-GMP水平升高,細菌進入生物被膜狀態。
此外,為了實現治療藥物的控制釋放,研究團隊為工程菌設計了第三種生活方式,即裂解狀態,通過c-di-GMP響應型啟動子表達裂解基因,可使細菌在c-di-GMP升高后進入裂解狀態(圖1)。這樣,細菌的三種生活方式便均與c-di-GMP的濃度相關。通過改變近紅外光的照射強度,可以控制活化的BphS蛋白的數量,進而調節工程菌胞內的c-di-GMP的濃度,從而實現對細菌生活方式的控制。
除了光照強度的影響,理論模擬的結果表明:PA2133上游的核糖體結合位點(RBS1)與抗終止蛋白Q上游的核糖體結合位點(RBS2)的強度將對使細菌進入不同的生活方式所需的近紅外光光強產生巨大的影響。
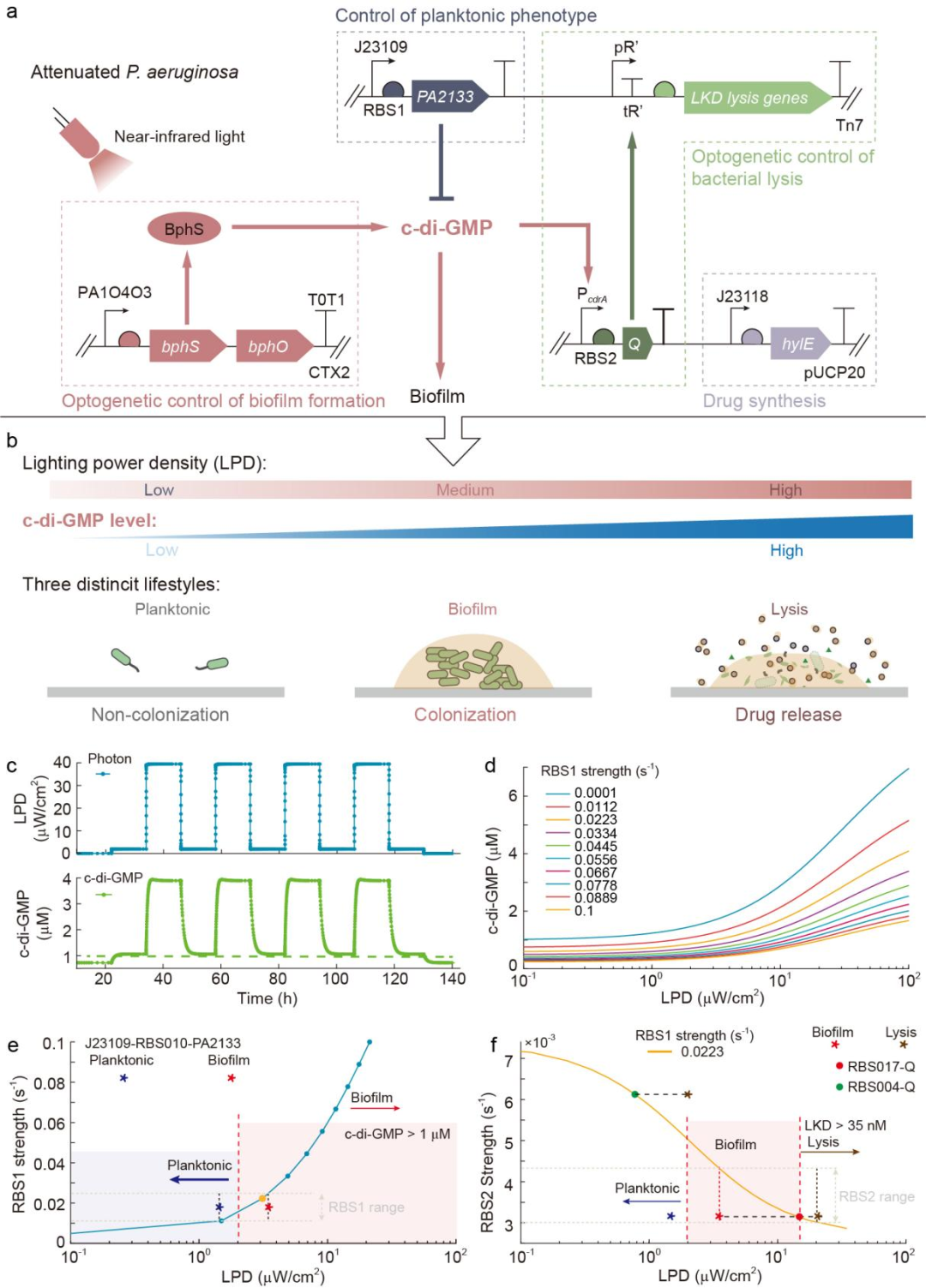
圖1 用于編程細菌生活方式的基因線路的設計
為了獲得能夠在不同強度的近紅外光照射下呈現三種生活方式的工程菌,研究團隊對RBS1和RBS2進行批量替換,并通過96孔光照裝置對候選菌株進行批量篩選,隨后利用顯微鏡進行驗證,最終得到的工程化菌株被命名為H017(圖
2)。通過層級性調控近紅外光的照射強度可以編程H017的生活方式,當對H017施加中等強度-高強度循環的近紅外光光照程序時,細菌將進入生物被膜狀態-裂解狀態生活方式循環。
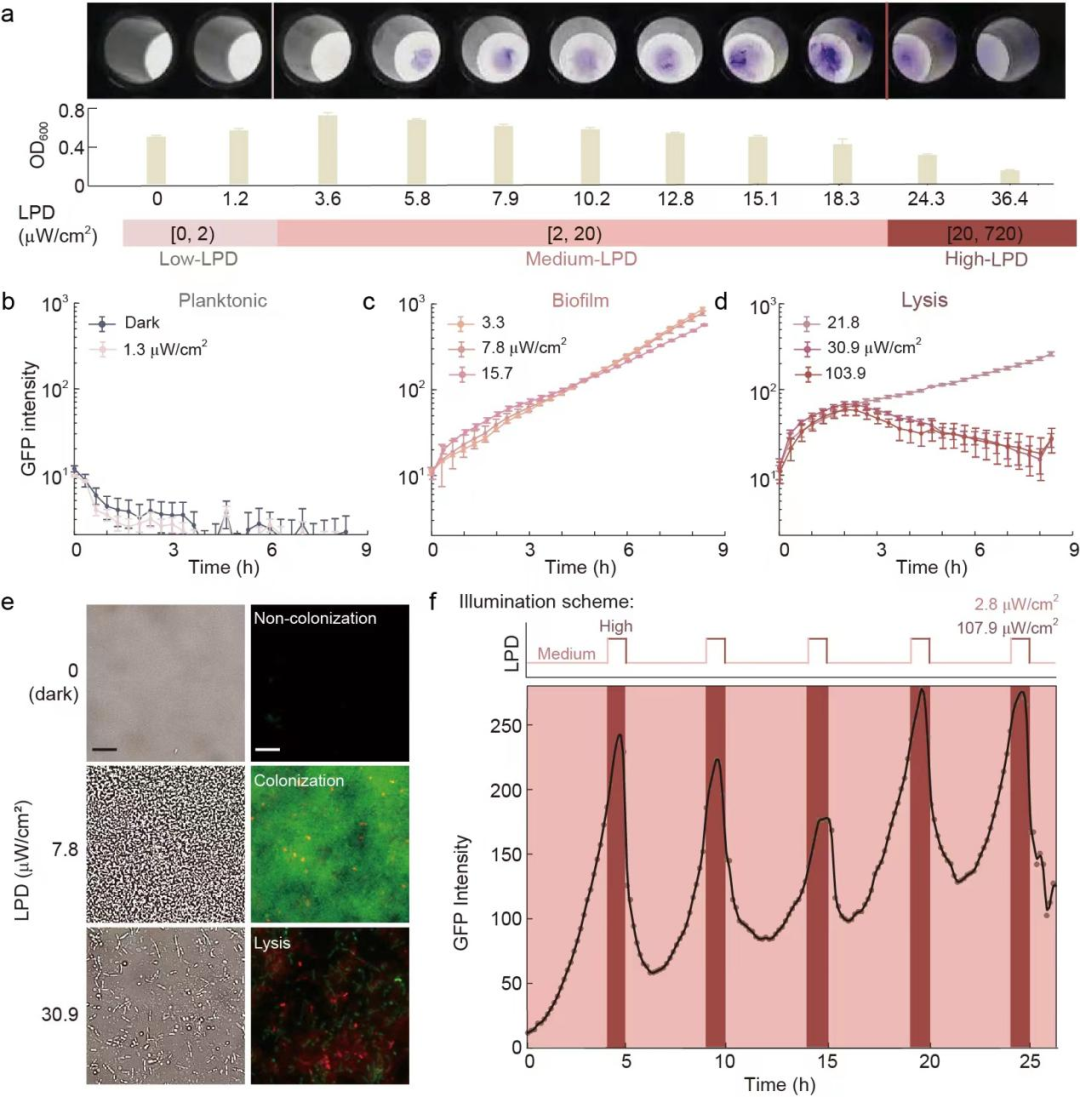
圖2 通過層級性調節近紅外光的強度編程細菌生活方式
為了在體外驗證工程菌的三種生活方式在腫瘤治療中的作用,研究團隊在微流通道中進行了細菌-細胞共培養實驗(圖3)。研究團隊首先證實,當對指定區域的細胞施加不同強度的近紅外光光照時,工程菌能夠精確地在該區域內進入對應的生活方式。當對指定區域的細胞施加中等強度-高強度的光照程序時,H017先進入生物被膜狀態并大量定殖在細胞表面,隨后進入裂解狀態釋放治療藥物造成細胞壞死。以上結果表明,能夠通過近紅外光對工程菌的生活方式進行高時空分辨率的控制。此外,綜合對照組實現的結果,研究團隊發現生物被膜狀態的藥物累積過程與裂解狀態的藥物釋放過程是H017殺傷腫瘤細胞的關鍵。
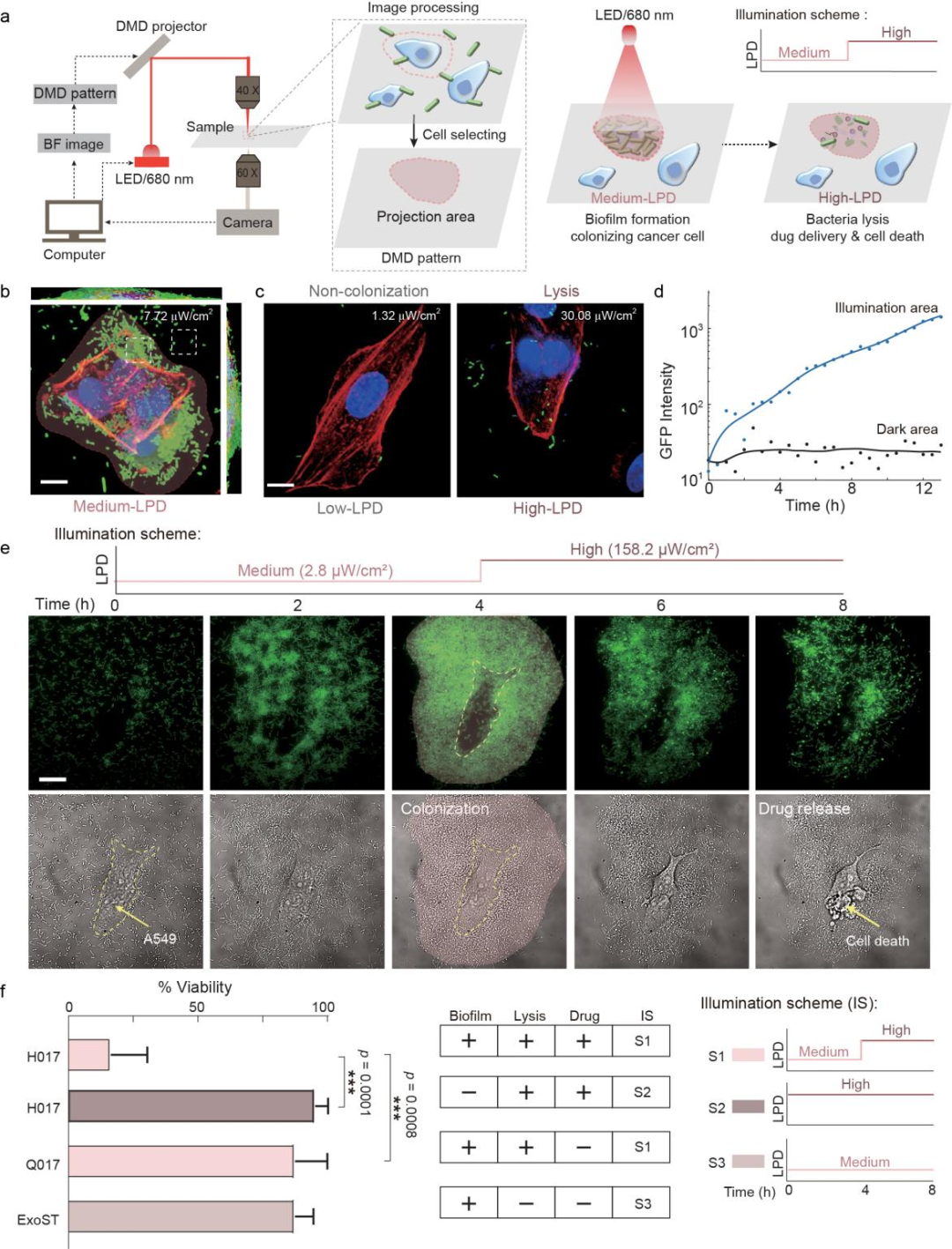
圖3 編程細菌“生物被膜-裂解”生活方式轉換實現藥物的控制釋放
隨后,研究團隊使用小鼠皮下瘤模型探究能否通過近紅外光控制工程菌在瘤內的生活方式并實現預期的功能(圖4)。結果顯示,在瘤內注菌后,避光培養三天組的小鼠(D3)腫瘤組織內的細菌數量與注射PBS組沒有顯著差異,表明進入浮游狀態生活方式的細菌難以在腫瘤內定殖;中等光強照射三天組的小鼠(M3)腫瘤組織內的細菌數量與D3組相比顯著增加,表明進入生物被膜狀態生活方式的細菌在腫瘤組織內的定殖能力大大增強;中等光強照射兩天高光強照射一天組的小鼠(M2-H1)與M3組相比,細菌數量顯著降低,且M2-H1組的腫瘤組織切片中能夠看出明顯的壞死區域,表明細菌裂解后釋放藥物并殺傷了腫瘤細胞;中等光強照射兩天高光強照射一天再中等光強照射兩天組的小鼠(M2-H1-M2)與M2-H1組相比,細菌數量再次上升,這表明細菌在中等光強照射后,再次進入定殖生長狀態。此外,在中等光強近紅外光照射七天后,瘤內的工程菌仍然具有裂解能力,表明該基因線路具有較好的穩定性。綜合以上結果可知,不同強度的近紅外光照射能夠使瘤內細菌進入對應的生活方式并實現預期的功能,而通過連續改變的光照程序能夠實現對瘤內細菌生活方式的持續控制。
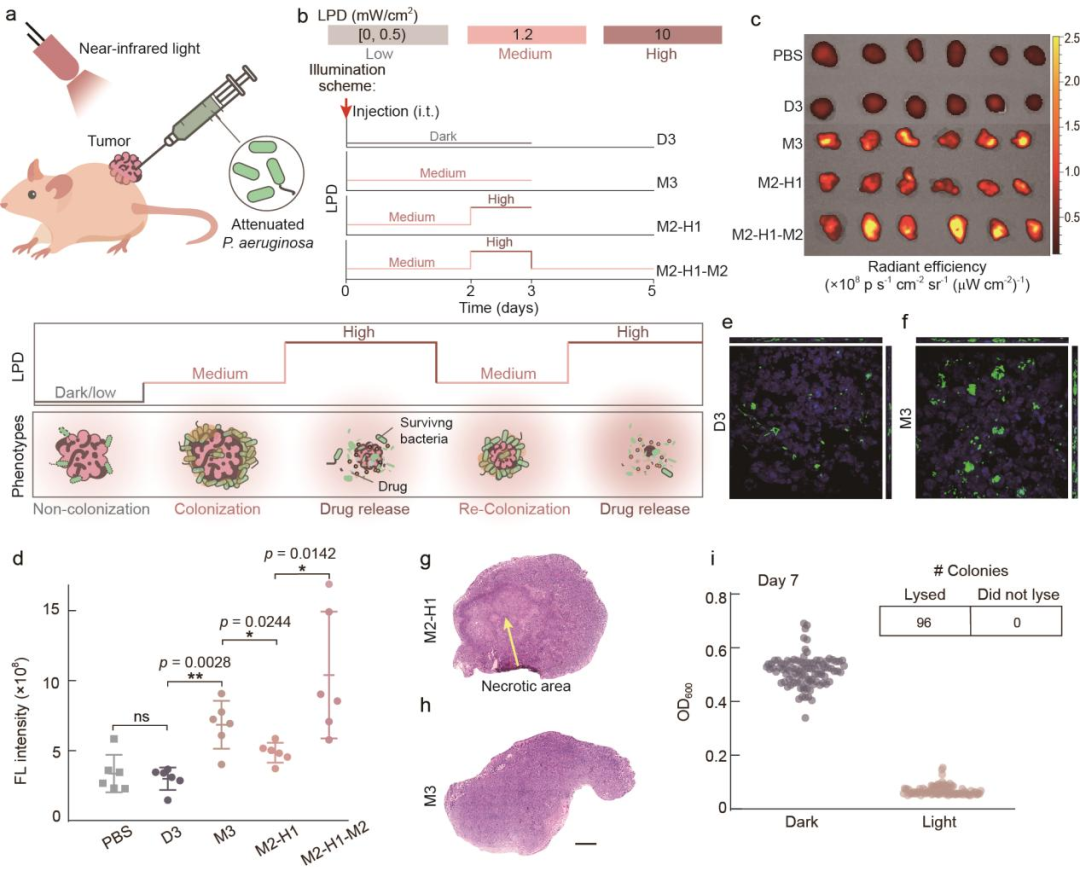
圖4 通過近紅外光操控實體瘤內的細菌生活方式
最后,研究團隊探究能否通過編程工程菌生活方式增強其腫瘤治療效果(圖5)。當H017僅作為藥物遞送載體時,高強度的近紅外光光照能夠使H017裂解釋放藥物,完成腫瘤治療。團隊在20天的實驗周期內,通過8次注菌,有效抑制了腫瘤生長。接下來,研究團隊通過光照程序對細菌的生活方式進行控制,以實現對藥物累積和藥物釋放的持續控制。結果顯示,在對小鼠施加兩個循環周期的中等強度2天-高強度1天的近紅外光光照程序(M2-H1×2)后,小鼠腫瘤生長受到了抑制,而對照組無法抑制小鼠腫瘤生長。在更長周期的實驗中(M2-H1×6),通過光照時間編程細菌生活方式進行腫瘤治療使所有小鼠的腫瘤生長受到了抑制,其中30%小鼠的腫瘤完全消失,而對照組小鼠的腫瘤則持續生長。以上結果表明,編程細菌生活方式在腫瘤的長期治療過程中具有顯著優勢,能夠在較少的注菌次數下獲得更好的腫瘤抑制效果。
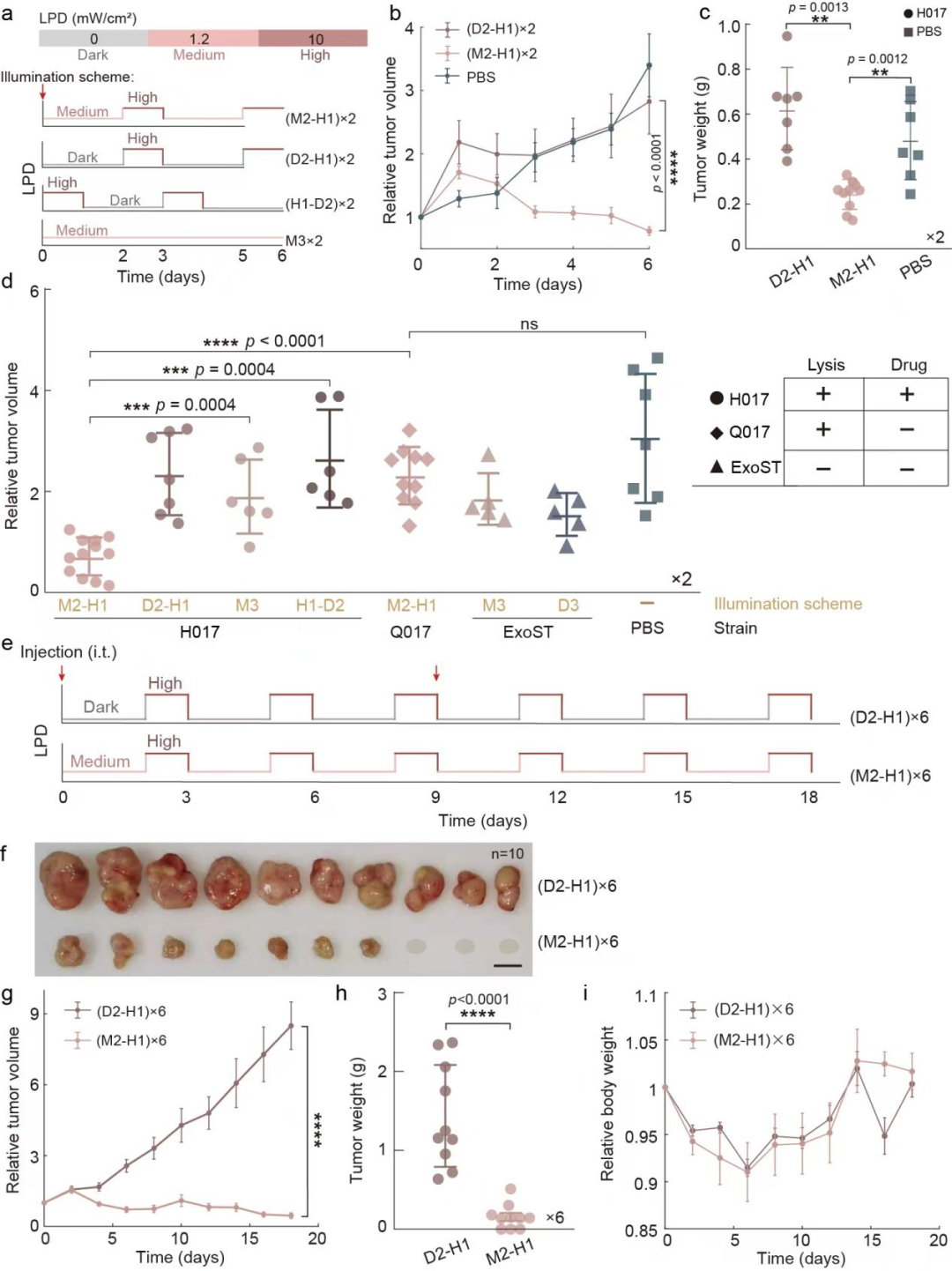
圖5 編程瘤內細菌生活方式促進實體瘤消退
審核編輯:劉清
-
編碼器
+關注
關注
45文章
3645瀏覽量
134575 -
顯微鏡
+關注
關注
0文章
565瀏覽量
23052 -
GMPL
+關注
關注
0文章
3瀏覽量
6286
原文標題:近紅外光控制的工程細菌,用于增強實體瘤治療效果
文章出處:【微信號:MEMSensor,微信公眾號:MEMS】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
近紅外光譜儀的原理和工作機制
如何使用便攜式礦物紅外光譜儀進行野外勘測
近紅外光譜的新曙光
使紅外光可見:新設備利用2D材料轉換紅外光
傅里葉變換紅外光譜儀技術在光伏材料性能表征中的應用與優化





 近紅外光控制的工程細菌用于增強實體瘤治療效果
近紅外光控制的工程細菌用于增強實體瘤治療效果











評論