納米微針是將外源性生物分子遞送至細胞的有效工具。盡管納米微針目前已被應用于多種疾病的治療,但關(guān)于細胞如何與納米微針相互作用的機制仍然缺乏研究。
近期,美國西北大學的Shana O. Kelley團隊提出了一種生成納米微針的新方法,并驗證了它們在藥物遞送中的實用性,研究了其在藥物遞送過程中的遺傳調(diào)節(jié)因子。研究人員首先基于電沉積法制造了納米微針陣列,并使用熒光標記的蛋白質(zhì)和siRNA量化了其遞送功效。值得注意的是,研究人員發(fā)現(xiàn)該納米微針會破壞細胞膜,增強細胞-細胞連接蛋白的表達,并下調(diào)NFκB通路轉(zhuǎn)錄因子的表達。這種擾動使得大部分細胞停留在細胞的內(nèi)吞活性最高的G2期。該系統(tǒng)為研究細胞與高縱橫比材料之間的相互作用提供了一個新模型。
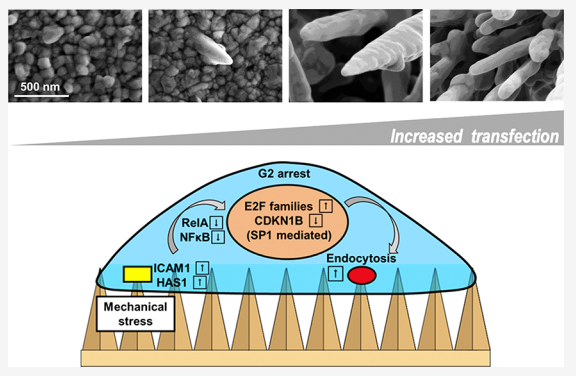
金納米微針用于原代細胞或干細胞的細胞內(nèi)遞送示意圖
將外源性生物分子遞送到細胞中是基因組編輯和細胞治療的基礎。現(xiàn)有方法通常涉及使用危險、有毒或低效的病毒、電場或化學試劑。因此,有效且具有成本效益的細胞內(nèi)遞送方法且細胞毒性和細胞應激最小的策略尚未得到開發(fā)。 特征尺寸為100 μm~500 μm的微針已被證明具有細胞內(nèi)遞送的功能。然而,通過被動擴散為主的微針的遞送效率通常很低(8%到20%)。
此外,人們開發(fā)出通過微針介導的電穿孔將質(zhì)粒主動遞送到細胞中。盡管效率提高到50%,但該裝置需要高電壓 (>50 V) 才能運行。 相比之下,高縱橫比納米材料,尤其是特征尺寸為100 nm~1000 nm的垂直納米微針,在體外細胞內(nèi)遞送包括核酸、納米粒子、治療藥物、蛋白質(zhì)和代謝物中表現(xiàn)出廣泛的實用性、高效率(高達95%)和較小的細胞毒性作用。此外,納米微針已被引入用于原位基因/免疫治療,并在動物模型和體內(nèi)取得了令人鼓舞的結(jié)果。納米微針已被證明是一種安全有效的細胞內(nèi)遞送工具。
盡管在實驗室層面取得了成功,但納米微針從實驗室到臨床的轉(zhuǎn)化非常有限。其中有幾個關(guān)鍵挑戰(zhàn)仍未解決。事實上,納米微針的制造通常涉及使用反應離子蝕刻(RIE),這是昂貴、不可擴展、勞動密集型的,并且需要集中的潔凈室設施。RIE的使用極大地阻礙了納米微針的大規(guī)模制造。
此外,先前的研究已經(jīng)利用已建立的癌細胞系來評價遞送效率,例如淋巴細胞癌。這些癌細胞系通常易于轉(zhuǎn)染,因此不能很好地代表用作治療的原代細胞或干細胞。 此外,目前已有的研究尚未系統(tǒng)地了解納米微針介導的細胞內(nèi)遞送的原理。在一些研究中提出,納米微針只是通過膜破裂穿透細胞膜,而其他人則認為滲透模型過度簡化了細胞-納米微針界面。納米微針的存在可以通過細胞膜的動態(tài)生化和生物力學調(diào)節(jié)促進生物分子的攝取。
最近的一項研究還強調(diào),納米微針甚至可以通過機械轉(zhuǎn)導調(diào)節(jié)核基因的表達。總之,這些發(fā)現(xiàn)表明需要深入研究細胞-納米微針界面。
研究人員最近引入了用于研究細胞和納米結(jié)構(gòu)之間相互作用的電沉積電極。該電沉積方法高度可調(diào),可以在模板介導或無模板的的情況下制造具有不同程度納米結(jié)構(gòu)。值得注意的是,具有高度可調(diào)的幾何形狀和密度的納米微針可以通過簡單的設置在幾分鐘內(nèi)沉積到裸露的金表面。這促使該電沉積能夠作為一種快速、無RIE制造納米微針的方法。
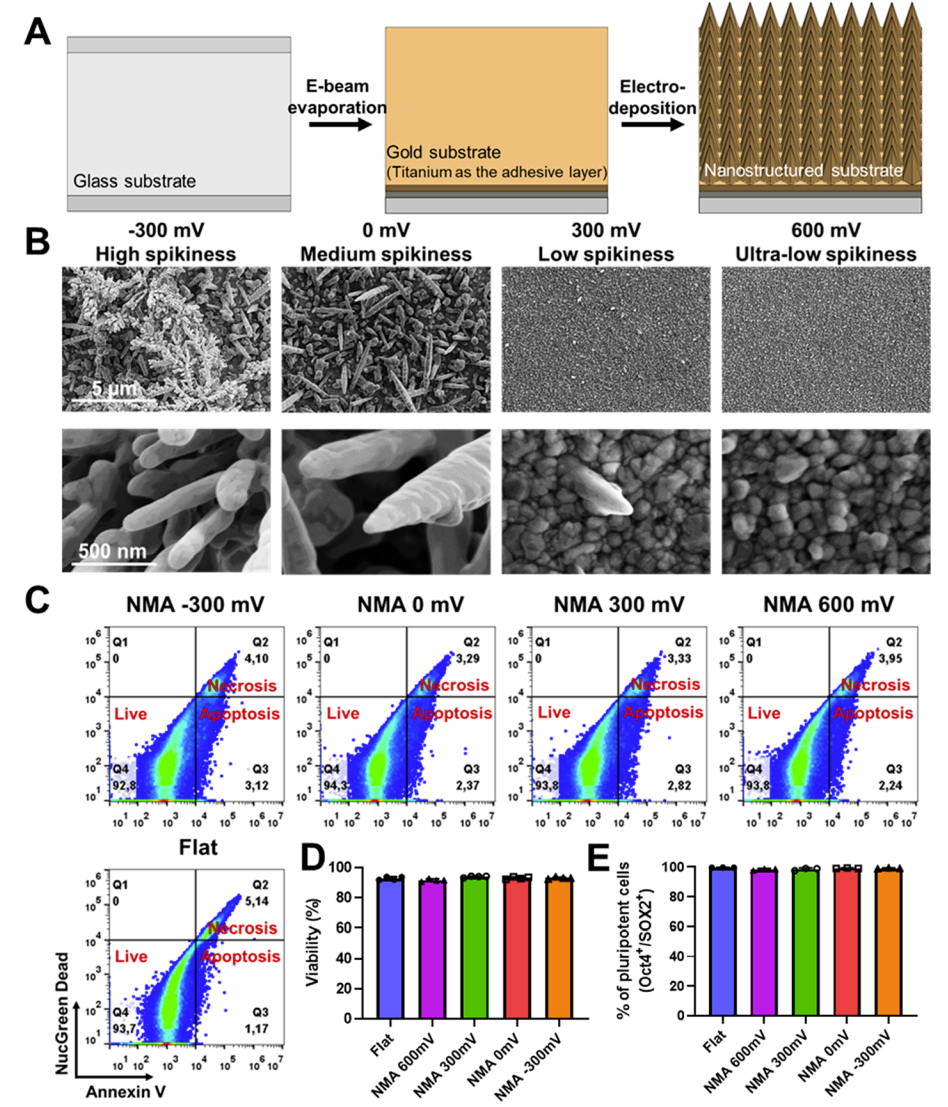
具有可調(diào)形態(tài)和納米微針密度的生物相容性納米微結(jié)構(gòu)(NMA)的電沉積
在該項研究中,研究人員首次報告了使用電沉積來制造金納米微針,用于難以轉(zhuǎn)染的原代細胞和干細胞的細胞內(nèi)遞送。電沉積方法快速、無RIE、可擴展且成本相對較低。研究人員研究了納米微針形態(tài)、遞送效率和細胞毒性之間的關(guān)系。基于膜聯(lián)蛋白V的染色,研究人員發(fā)現(xiàn)具有不同形態(tài)的金納米微針對細胞的活力和凋亡影響最小。
在 0 mV和~300 mV的電壓下沉積的高尖納米微針具有更好的遞送效率。在電沉積納米微針的幫助下,各種外源性生物分子(葡聚糖、白蛋白、轉(zhuǎn)鐵蛋白、量子點、siRNA)被成功地遞送至原代細胞和干細胞中,包括多能干細胞、間充質(zhì)干細胞、內(nèi)皮細胞和原代成纖維細胞。
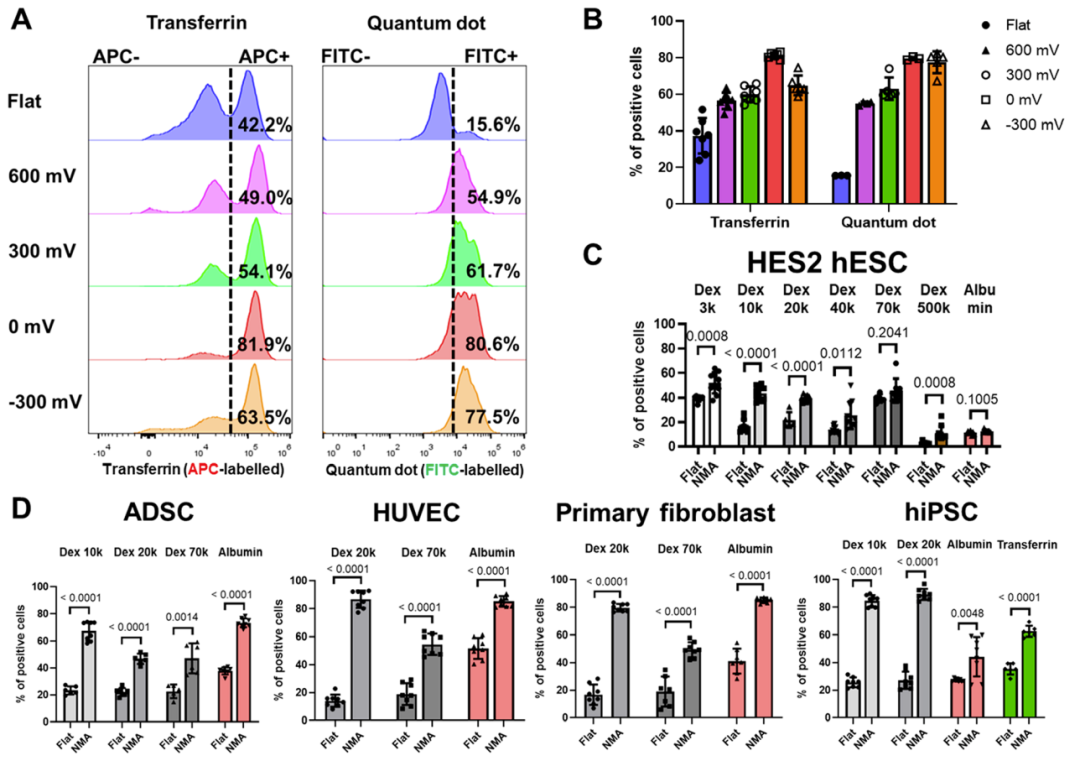
含有高密度納米針的NMA促進各種生物分子在多個難以轉(zhuǎn)染的原代細胞中的遞送
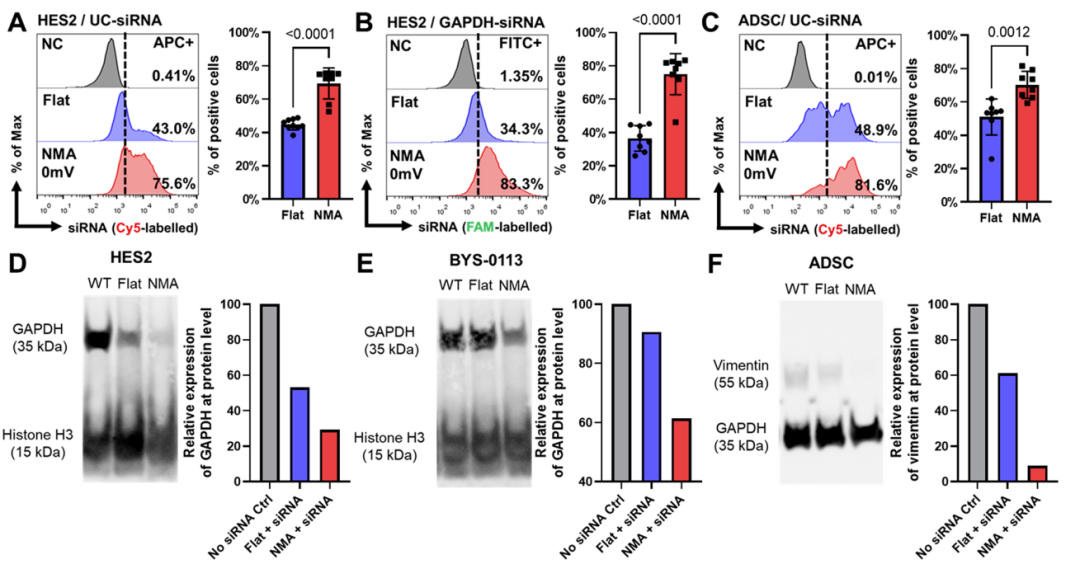
含有高密度納米針的NMA促進siRNA的轉(zhuǎn)染,并在蛋白質(zhì)水平上產(chǎn)生顯著的抑制作用
研究人員還研究了提高效率的潛在機制,并發(fā)現(xiàn)電沉積納米微針通過阻止細胞進入G2細胞周期來促進生物分子的內(nèi)吞作用。進一步的微陣列和質(zhì)譜分析表明,這種細胞周期停滯源于細胞膜上的有限粘附,通過NFκB途徑轉(zhuǎn)導至細胞核,并通過調(diào)節(jié)細胞核中的E2F和CDK蛋白實現(xiàn)。綜上所述,該研究結(jié)果證明了電沉積金納米微針對于生物分子的遞送的效用,并提供了復雜納米結(jié)構(gòu)與原代細胞之間相互作用的生物學原理。
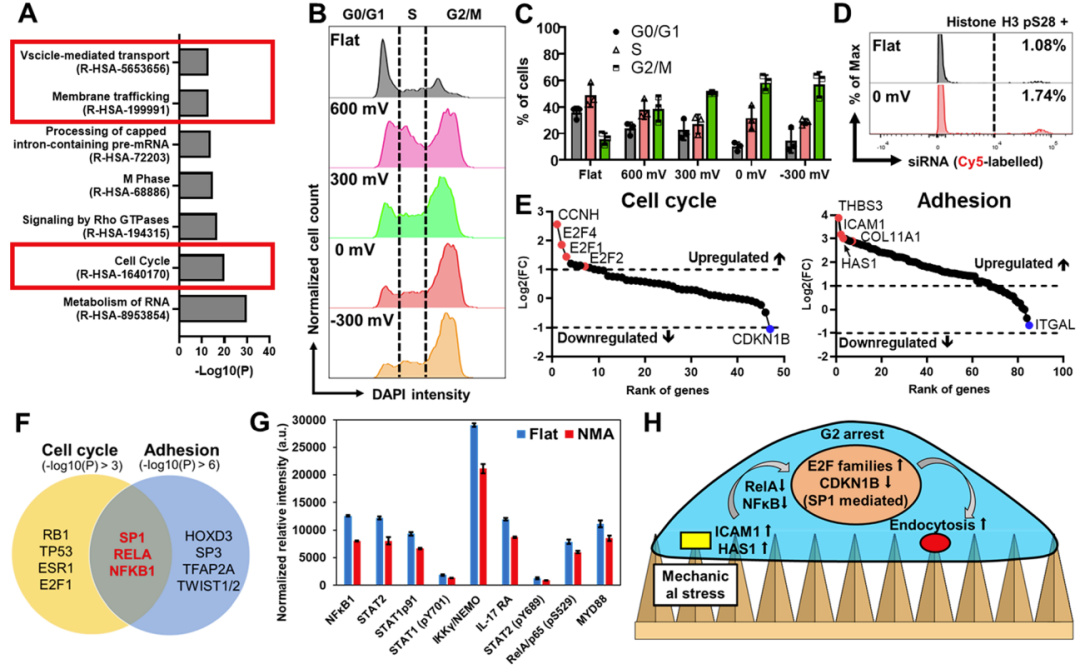
NMAs通過細胞周期停滯促進膜運輸
綜上所述,研究人員開發(fā)了一種快速、無RIE的策略來通過電沉積制造具有可調(diào)納米結(jié)構(gòu)的納米微針(NMA)。NMA可顯著促進原代細胞對蛋白質(zhì)和siRNA的內(nèi)吞作用,從而提高基因敲低的效率。研究人員對轉(zhuǎn)錄組和蛋白質(zhì)組進行了全面分析,以揭示其潛在機制。結(jié)果表明,內(nèi)吞作用是通過 NFκB通路從NMA轉(zhuǎn)導到細胞核的細胞周期停滯的結(jié)果。總之,研究人員的研究結(jié)果表明,生物界面中高縱橫比納米結(jié)構(gòu)的存在可以引起比膜變形更復雜的生物反應。與納米結(jié)構(gòu)的相互作用將改變多種細胞內(nèi)過程,例如信號轉(zhuǎn)導和細胞周期。重要的是,納米結(jié)構(gòu)誘導的細胞周期停滯可用于改善細胞內(nèi)吞過程并產(chǎn)生有效的細胞內(nèi)遞送。在設計未來的多功能生物界面以進一步提高藥物輸送的效率時,具有廣泛的應用前景。
審核編輯:劉清
-
高電壓
+關(guān)注
關(guān)注
1文章
148瀏覽量
18162
原文標題:基于電沉積法制備的納米微針,實現(xiàn)藥物在原代細胞內(nèi)的有效遞送
文章出處:【微信號:Micro-Fluidics,微信公眾號:微流控】歡迎添加關(guān)注!文章轉(zhuǎn)載請注明出處。
發(fā)布評論請先 登錄
相關(guān)推薦
應用于活細胞成像的一次性細胞培養(yǎng)芯片
使用原代腫瘤細胞進行藥物篩選的數(shù)字微流控系統(tǒng)
產(chǎn)業(yè)革命?液相法制備碳化硅襯底實現(xiàn)交付!
半侵入式"可穿戴診所"——微針技術(shù)的創(chuàng)新應用
ATA-7020高壓放大器在微流控3D細胞微球培養(yǎng)中的應用
寬帶功率放大器基于微流控技術(shù)的細胞分選的應用
利用微流控探針誘導的化學質(zhì)膜穿孔,實現(xiàn)單細胞胞內(nèi)蛋白質(zhì)遞送
ATA-7010高壓放大器在納米薄膜制備中的作用有哪些
集成微流控功能模塊的可重編程磁控柔性驅(qū)動器制備工藝
安泰ATA-7050高壓放大器在微流控細胞分選中的應用
采用LIBS成像技術(shù)研究納米顆粒在單細胞內(nèi)的亞細胞分布





 基于電沉積法制備的納米微針實現(xiàn)藥物在原代細胞內(nèi)的有效遞送
基于電沉積法制備的納米微針實現(xiàn)藥物在原代細胞內(nèi)的有效遞送












評論