研究背景
傳統鋰離子電池 (LIB) 中使用的關鍵礦物(Li、Ni 和 Co)供應緊張且成本高昂,這促使人們對非鋰電池化學物質的興趣與日俱增。氟化物離子電池 (FIB) 利用氟化物穿梭在具有不同(脫)氟化電位的兩個電極之間。氟離子的高還原電位歸因于其高電負性,保證了電化學穩定性,允許高工作電壓,而單電荷和小離子半徑可實現出色的傳輸特性與多價電荷載流子(例如 Mg2+、Ca2+、Al3+)相比極化最小,此外還具有高氟化物元素豐度所帶來的經濟和環境優勢。此外,使用基于過渡金屬氟化物的轉換電極可以提供理論多電子轉換和過渡金屬的高理論容量使能量密度高達 1393 Wh L?1 (588 Wh kg?1)。盡管有許多努力來發現和研究 RT氟化物導電材料。然而,這些優點尚未完全實現可逆和高能量密度室溫 (RT) 下的 FIB,大多數先前報道的 FIB 在 80 °C 以上的工作溫度下使用固態電解質,以及最近在 60 °C 下使用固態電解質,
成果簡介
近日,牛津大學Mauro Pasta報告了在 FIB 中使用鹽中溶劑電解質,探索多種溶劑以表明氟化銫水溶液具有足夠高的溶解度以實現增強的(電)化學穩定性窗口(3.1 V),從而實現高操作電壓電極,除了抑制活性材料溶解外,還可以提高循環穩定性。還使用光譜和計算方法研究了電解質的溶劑化結構和傳輸特性。
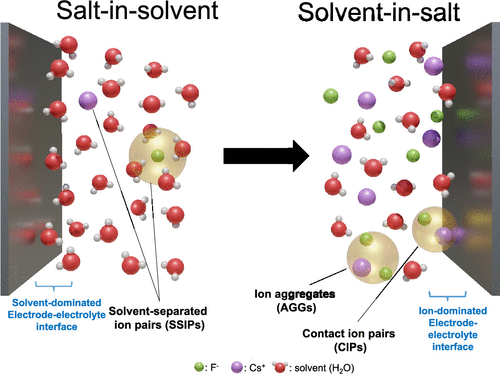
Scheme 1 隨著濃度從溶劑中的鹽電解質增加到鹽中的溶劑電解質
研究亮點
(1) 在FIB中使用鹽中溶劑電解質極大的擴寬了電解液的電化學穩定窗口,實現了和高電壓電極的匹配同時抑制電極活性材料的溶出。
(2) 以Pb/PbF2復合電極,以鹽中溶劑為電解質實現了電極的高度可逆重復脫氟和氟化。
圖文導讀
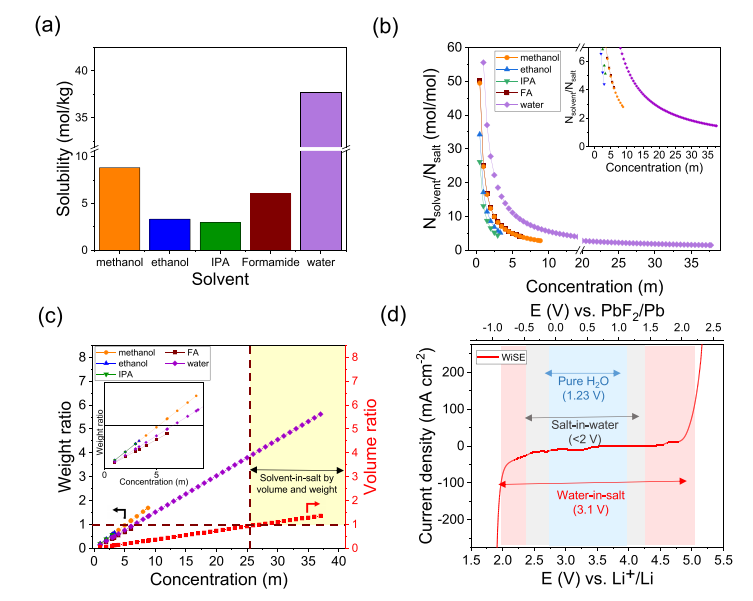
圖 1. 使用 ICP-MS 測定的 CsF 在普通質子溶劑中的溶解度 (a),溶劑與鹽的摩爾比顯示 CsF 在水中的配位數 <2 (b),鹽與溶劑的重量和體積比顯示“鹽中溶劑”的濃度范圍 (c),以及與純水和其他水性電解質 (d) 相比,鹽中水電解質(這項工作)的電化學穩定性窗口擴展。
眾所周知,水性電解質具有較窄的 ESW,這阻礙了高工作電壓電極對的使用并限制了能量密度。為了探索鹽包水電解質 (WiSE) 對擴展 ESW 的影響,對多個濃度進行了線性掃描伏安法。隨著濃度增加到 25 m 以上,穩定性窗口顯示擴大到 3.1 V 左右(圖 1d)。ESW 的這種增強是游離水分子活性降低和溶劑化結構發生變化的結果,其中電極-電解質界面由離子物質而不是電化學不穩定的游離水分子主導。最近,針對 FIB 報道了濃縮水性電解質,但在 ESW (2.1 V) 中表現出有限的膨脹,可能是由于 KF 的較低溶解度強加了大部分游離水分子。
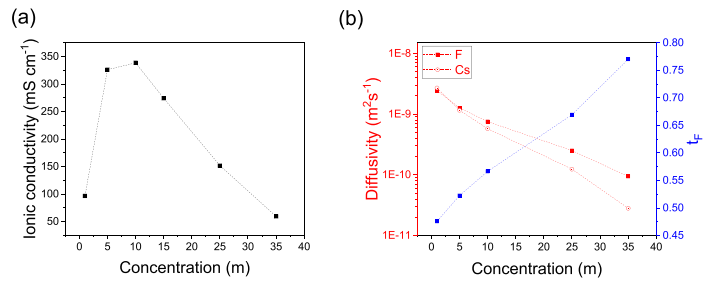
圖 2. 氟離子和銫離子的離子電導率 (a) 和擴散系數以及氟化物傳輸數 (b) 作為濃度的函數。
由于預計鹽包溶劑電解質具有阻礙離子傳輸的高粘度,因此分別使用電化學阻抗譜和脈沖場梯度核磁共振 (PFG NMR) 譜測量離子電導率和擴散率。發現離子電導率在 10 m 左右達到峰值,25 m 電解質的電導率為 152 mS cm?1(圖 2a),比之前報道的 FIB 有機電解質高 2 個數量級。氟化物和銫離子擴散率,由于粘度增加,對于 1 m 電解質,分別從 2.45 × 10?9 和 2.70 × 10?9 m2 s -1 下降到2.51 × 10?10和1.24 ×10?10 m2 s-1,對于 25 m 電解質(圖 2b)。然而,相對氟化物離子擴散顯示在較高濃度下顯著改善,如較高傳輸數所證明的那樣(圖 2b)。
這種改善的氟化物遷移率可能歸因于濃縮電解質中更強的 O-Cs 絡合,因為競爭性 O-H 溶劑-溶劑相互作用由于較低的水活度而減弱。17O NMR 通過在較高化學位移處顯示水氧峰證實了這一假設,表明更多的去屏蔽氧,此外還有明顯的變寬表明“類固體”和流動性較低的水分子(圖 3a),而 1 H NMR 顯示反向趨勢,表明弱化的溶劑-溶劑 O-H 鍵和增強的 O-Cs 鍵。這種與銫離子強烈絡合的幾乎不動的水網絡允許更自由的氟離子遷移。先前在鋰離子電解質的研究中提出了類似改進的陰離子遷移,已知與陰離子相比,陽離子與溶劑的結合更強。
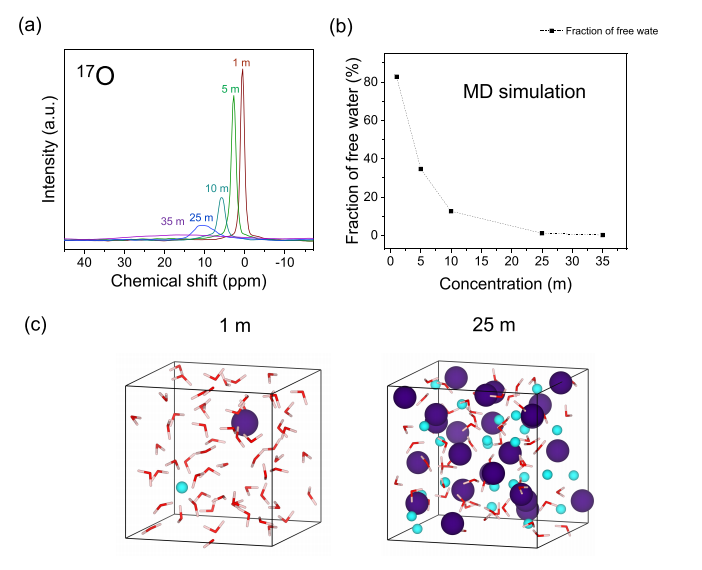
圖 3. 鹽包水電解質的溶劑化特性。17O NMR 光譜顯示隨著水分子的流動性降低,峰展寬和峰偏移 (a),從 MD 模擬計算的游離水分子分數 (b),以及 1 和 25 m 處的 MD 松弛結構顯示接觸離子的形成配對和聚集并消除游離水分子(c)。
使用光譜和計算方法對溶劑化結構進行表征,以探索從溶劑-離子到離子-離子主導相互作用的演變(圖 3)。分子動力學 (MD) 模擬顯示濃縮電解質中離子對和聚集體的存在增加(圖 3c,圖 S3),此外游離水分子的比例迅速下降(圖 3b)。溶劑化結構的這種變化反映在水分子的 17O NMR 光譜中,其中去屏蔽增加是由于較高比例的水分子將其氧電子提供給 Cs 離子,并支持 ESW 中的膨脹(圖1d).
氟離子的化學穩定性一直是 FIB 中的一個主要問題,不謹慎的電解質設計會導致氟離子形成腐蝕性 HF。在質子介質中,由于 HF/F- 平衡導致的快速氫交換已知會導致單個 19F NMR 信號在所有氟化物物種的平均位置具有化學位移,使得 19F NMR 不足以量化 HF 含量在質子溶劑中。然而,考慮到 pKa 值為3.8,稀釋的水性氟化物電解質仍預計會有一些平衡 HF,盡管這并沒有阻止它們在之前的報告中穩定和可逆地循環超過 1000 個循環。因此,HF 分數是根據質子計算的。
鑒于在超高濃度 (>17 m) 下電位 pH 測量的有效性,活性測量。隨著提供質子的水分子變得更加稀少并且溶液更加堿性,WiSE 中的 HF 含量被發現降低到接近零(圖 4a)。19F NMR 中越來越去屏蔽的氟化物進一步證實了這一觀察結果(圖 4b)。盡管由于影響化學位移的其他因素(溶劑電偶極子、磁各向異性等)難以比較多種溶劑中氟離子的“裸露度”,但比較同一溶劑中的化學位移是氟化物的有效代表溶劑化環境。在這種情況下,隨著濃度的增加,氟化物從 HF 區域(-160 至 -170 ppm)移開,越來越像有機溶劑中裸露的、配位較少的氟化物。
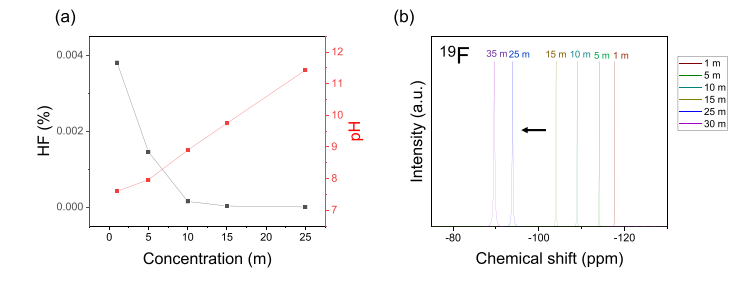
圖 4. 氟離子化學物質和電子環境。pH 作為濃度的函數,表明 HF 含量 (a) 和 19F NMR 光譜 (b) 的衰減。
此外,對于 WiSE,這種化學穩定性伴隨著熱穩定性的增加,由于熔點受到抑制而具有更高的分解溫度開始和更寬的液體范圍。
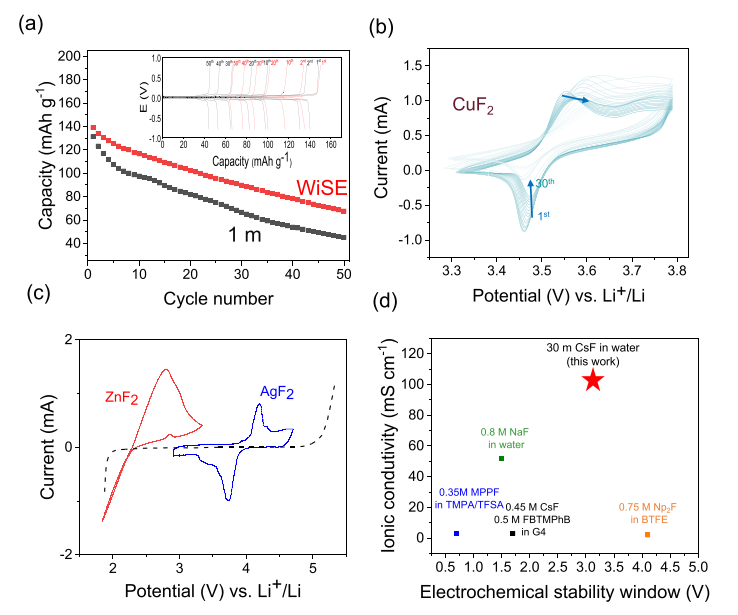
圖 5. 對稱 Pb|PbF2 在 1 和 25 m 處的恒電流循環顯示 WiSE 中的容量保持得到改善 (a) CuF2 在 25 m 電解質中的循環伏安法 (b) 以及 AgF2 和 ZnF2 在 WiSE 氧化和還原極限附近的循環伏安法 (c)。基于 ESW 和電導率 (d) 的選定氟離子電池電解質的性能比較。
最后,為了探索 WiSE 的 RT 循環性能,對 25 m 電解質進行了恒電流循環和 CV,因為它在鹽包水特性(寬 ESW 和低水分數)和傳輸特性(擴散系數和離子電導率)。對稱 Pb|PbF2 紐扣電池以 C/10 速率循環,低濃度電解質顯示出更快的容量衰減(圖 5a)。這歸因于活性物質在較低濃度下的溶解加劇(給定溶度積 Ksp,較低的氟化物濃度會導致較高的金屬離子溶解),這是已知在以前的基于金屬氟化物轉化的 FIB 中有害的問題。然而,WiSE 顯示出改進和更穩定的容量保持,隨著進一步循環,這種差異化的循環性能預計會變得更加明顯。對于這個對稱電池,增加的循環顯示到第 100 個循環時稀釋電解質的容量完全損失。
WiSE 的循環針對 CuF2 進行了進一步證明,其中 CV 顯示 30 個循環,而之前的 CuF2 CV 報告則在第 10 個 CV 循環時溶解導致完全容量損失。CuF2 溶解的顯著抑制也被目視觀察為藍色歸因于溶解的 [Cu(H2O)]2+ 在 25 m 電解質處被消除。CuF2被認為是 FIB 陰極材料的圣杯,因為它具有高還原電位和高容量 (528 mAh g?1),并且 WiSE 可以成為允許其 RT 穩定循環的系統。此外,AgF2 的循環顯示在電位超過 4 V(相對于 Li+ /Li)的氟化物穿梭系統中,同時 ZnF2 的循環更接近 ESW 的陰極極限(圖 5c)。通過進一步優化粒徑、陰極制造和仔細選擇陽極材料,WiSE 具有允許進一步研究氟化機制并允許高壓 (>2 V) FIB 循環的優點。
總結與展望
總之,鹽包水電解質顯示出大多數氟離子電池電解質所缺乏的室溫傳輸特性和(電)化學穩定性。氟離子的核磁共振譜與 pH 值測量相結合,顯示幾乎完全抑制了氟化氫的形成,從而提高了化學穩定性。MD 模擬和 17O NMR 揭示了溶劑化結構并顯示了游離溶劑分子的消除,證實了擴大的電化學穩定性窗口背后的機制。最后,我們對循環性能的初步研究表明,濃縮電解質,使循環更穩定,活性物質溶解得到抑制,為CuF2等高容量正極材料的循環和氟化轉化機理研究提供了途徑。
審核編輯:劉清
-
鋰離子電池
+關注
關注
85文章
3242瀏覽量
77757 -
鋰電池
+關注
關注
260文章
8124瀏覽量
170469 -
電解質
+關注
關注
6文章
814瀏覽量
20083 -
電解液
+關注
關注
10文章
848瀏覽量
23141 -
固態電解質
+關注
關注
0文章
84瀏覽量
5448
原文標題:牛津大學Mauro Pasta?ACS Energy Letters:用于氟離子電池的溶劑型鹽電解質
文章出處:【微信號:清新電源,微信公眾號:清新電源】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦
Li3MX6全固態鋰離子電池固體電解質材料
一種薄型層狀固態電解質的設計策略
半互穿網絡電解質用于高電壓鋰金屬電池
鈉電新突破:實現寬溫長壽命電池的電解液革新
無極電容器有電解質嗎,無極電容器電解質怎么測
電解質電極信號采集控制板

不同類型的電池的電解質都是什么?
新型固體電解質材料可提高電池安全性和能量容量
固態電解質離子傳輸機理解析




 用于氟離子電池的溶劑型鹽電解質
用于氟離子電池的溶劑型鹽電解質











評論