近20年來,隨著微全分析系統(tǒng)(Micro-total-analysis syste, μTAS)和芯片實(shí)驗(yàn)室(Lab-on-chip, LOC)概念的提出,微流控技術(shù)的興起對(duì)分析科學(xué)乃至整個(gè)自然科學(xué)體系的發(fā)展產(chǎn)生了巨大的推動(dòng)作用。微流控技術(shù)作為一種基于微尺度效應(yīng)的流體處理技術(shù),其核心理念是通過構(gòu)建微納器件將復(fù)雜的實(shí)驗(yàn)室功能集成于單個(gè)分析設(shè)備或芯片上,實(shí)現(xiàn)分析系統(tǒng)的微型化與集成化。常規(guī)的微流控芯片以微通道為主體,通過閥、泵等外部構(gòu)件實(shí)現(xiàn)對(duì)通道內(nèi)微流體的操作和控制。然而,此類芯片結(jié)構(gòu)復(fù)雜,加工難度大;需要外置泵、閥配合使用,難以集成化;易產(chǎn)生通道“死體積”,引起交叉污染。因此,近年來對(duì)微液滴操縱與控制新方法的研究成為國際微流控領(lǐng)域的研究重點(diǎn)。
數(shù)字微流控技術(shù)(Digital microfluidics, DMF)是一類新型液滴操縱技術(shù)的統(tǒng)稱,常見的驅(qū)動(dòng)法有介電潤濕、介電泳、聲表面波、靜電力、磁力等。本文中DMF特指介電潤濕型的液滴操縱技術(shù),其利用液滴在疏水化表面的介電潤濕現(xiàn)象,通過控制微電極陣列上液滴接觸角變化,實(shí)現(xiàn)離散液滴的精確控制。相比于傳統(tǒng)基于微通道的微流控芯片,DMF技術(shù)既保留了樣品消耗量少、熱轉(zhuǎn)換快速,以及具有高并行性和自動(dòng)化的能力,同時(shí)不依賴微泵、微閥或微混合器等元件,甚至無需復(fù)雜的三維流體通道,具有構(gòu)建簡單、可動(dòng)態(tài)配置的優(yōu)點(diǎn),因此特別適用于高集成度、高性能、操作復(fù)雜的生物、化學(xué)微全分析體系。
本文基于分析化學(xué)的視角對(duì)現(xiàn)階段DMF技術(shù)的發(fā)展進(jìn)行了總結(jié),同時(shí)分別在液滴驅(qū)動(dòng)理論、芯片構(gòu)建及具體應(yīng)用等方面加以闡述。
數(shù)字微流控理論基礎(chǔ)
介電潤濕(Electrowetting-on-dielectric, EWOD)是指通過改變絕緣基板之間電壓,來改變基板上液滴的潤濕性(即改變接觸角),使液滴發(fā)生形變、位移的現(xiàn)象。其機(jī)理主要有兩種①Lippmann的能量觀點(diǎn),即微液滴與介電層之間電荷積累產(chǎn)生的電容效應(yīng)導(dǎo)致能量變化,引起微液滴表面張力改變從而使得接觸角變化。該理論用Lippman-Young方程描述EWOD現(xiàn)象,此方程由Berge在20世紀(jì)90年代通過合并Lippmann方程和Young方程得出:
cosθ = cosθ0+ ε0εrV2/( 2γ?)
式中,ε0表示真空介電常數(shù);εr表示導(dǎo)電液滴的相對(duì)介電常數(shù);γ表示氣/液表面的張力系數(shù);?為介質(zhì)層厚度;V為驅(qū)動(dòng)電壓;θ0和θ分別表示施加驅(qū)動(dòng)電壓前后的接觸角大小。由于該理論提出較早,相關(guān)的理論體系成熟,因此為多數(shù)人所接受。然而該理論無法解釋低表面張力液體無接觸角變化、不對(duì)稱EWOD效應(yīng)、接觸角飽和效應(yīng)等現(xiàn)象。基于此,2000年Digilo等提出了基于電動(dòng)力學(xué)的EWOD理論,主張微液滴三相接觸線上電荷累積產(chǎn)生的靜電力導(dǎo)致微液滴毛細(xì)管線張力改變,從而引起接觸角變化。該靜電力可用 Maxwell-Stress張量Tij表示(式2),其中,i和j分別為x、y和z軸的函數(shù),δij為張量積δ,E為液滴周圍的電場。該公式解釋了不經(jīng)歷接觸角變化的液滴運(yùn)動(dòng)。
Tij=ε(EiEj-0.5δijE2)
基于介電潤濕的DMF技術(shù)最早由杜克大學(xué)的Fair等和加州大學(xué)洛杉磯分校的Kim等分別提出。以雙平板為例(圖1B),上板接通零電極,下板的電極接驅(qū)動(dòng)電壓,液滴位于左右兩個(gè)驅(qū)動(dòng)電極之間,當(dāng)右側(cè)電極導(dǎo)通時(shí),由式(1)可知,微液滴處于施加電壓的電極表面一側(cè)濕潤性發(fā)生改變,液滴左右兩側(cè)的接觸角不同,其內(nèi)部產(chǎn)生的壓力差驅(qū)動(dòng)微液滴沿著施加電壓的電極方向運(yùn)動(dòng)。按時(shí)序給驅(qū)動(dòng)電極施加電壓,即可驅(qū)動(dòng)微液滴沿著預(yù)設(shè)的路徑運(yùn)動(dòng),實(shí)現(xiàn)對(duì)微液滴的操控。
數(shù)字微流控芯片的結(jié)構(gòu)與構(gòu)建
圖1B中描述了DMF設(shè)備的兩種常見模式:單平板模式(也稱為開放式)和雙平板模式(也稱為封閉式)。在單平板模式中,液滴直接負(fù)載于同時(shí)含有驅(qū)動(dòng)電極和地電極的單個(gè)基板上;在雙平板模式中,液滴被夾在兩個(gè)有電極的基板之間。通常上板是一個(gè)由連續(xù)透明的導(dǎo)電銦錫氧化物(ITO)層形成的地電極,下板有一系列刻蝕好的驅(qū)動(dòng)電極陣列。在這兩種模式中,下板均涂有絕緣介質(zhì)層,且所有表面均被一層疏水性涂層覆蓋。兩種設(shè)備通常在空氣中運(yùn)行,但越來越多的研究人員使用硅油等不與液滴混溶的材料作為填充介質(zhì),用以防止液滴揮發(fā)、減小液滴操縱所需的驅(qū)動(dòng)電壓。雖然兩種模式的驅(qū)動(dòng)原理類似,但單平板模式不能實(shí)現(xiàn)液滴的分裂及生成,而雙平板模式得益于三明治結(jié)構(gòu)對(duì)液滴的剪切力,可以實(shí)現(xiàn)液滴的生成、分裂、混合和移動(dòng),因此具有更廣泛的應(yīng)用。
圖1 數(shù)字微流控(DMF)芯片示意圖
A、DMF芯片上液滴操縱,包括混合、分裂、合并和生成;B、不同結(jié)構(gòu)DMF示意圖
芯片結(jié)構(gòu)的設(shè)計(jì)是DMF芯片實(shí)現(xiàn)液滴操縱功能的基礎(chǔ)。以雙平板模式為例,下板中驅(qū)動(dòng)電極陣列主要分為儲(chǔ)液池電極、反應(yīng)區(qū)電極及連接兩者的連接電極。儲(chǔ)液池電極面積較大,用于存儲(chǔ)反應(yīng)試劑,并通過連接電極的逐級(jí)牽引實(shí)現(xiàn)液滴的生成。所生成液滴的體積由其被牽引到的最后一個(gè)電極的面積控制,體積的均一性受被操縱的電極形狀和電極數(shù)目影響;反應(yīng)區(qū)電極是DMF芯片的主體部分,通過在反應(yīng)區(qū)電極上的液滴操縱實(shí)現(xiàn)不同的功能,所需要的功能越復(fù)雜,反應(yīng)區(qū)電極數(shù)目越多。針對(duì)不同目的,可在反應(yīng)區(qū)電極上進(jìn)行多層結(jié)構(gòu)加工,包括納米探針、溫控模塊或三電極體系等,這是不同的DMF芯片結(jié)構(gòu)上最大的區(qū)別。
在DMF芯片中,基板材料決定了芯片的加工過程和電極陣列的設(shè)計(jì)。玻璃優(yōu)良的化學(xué)惰性使之成為DMF芯片基板的首選。然而復(fù)雜的加工過程和高昂的價(jià)格使其難以大規(guī)模推廣。近年來,將造價(jià)低且易批量生產(chǎn)的印刷電路板(Printed circuit board, PCB)用作DMF芯片的基板受到眾多研究人員的推崇,這是因?yàn)槎鄬覲CB板的構(gòu)建解決了玻璃和硅片芯片基板電極與外接點(diǎn)間布線困難的問題,使得大規(guī)模電極陣列的構(gòu)建成為可能。此外,包括紙、柔性材料等基底的引入使得DMF芯片可應(yīng)用于不同需求。表1總結(jié)了現(xiàn)階段DMF芯片常用的基底及其優(yōu)缺點(diǎn)。
DMF芯片的電極一般由金屬或其它導(dǎo)電材料構(gòu)成。介電層用于促進(jìn)電荷的積累和增加電場強(qiáng)度,以保證易于驅(qū)動(dòng)液滴且不會(huì)造成擊穿。根據(jù)材料的不同,可選擇氣相沉積(派瑞林、氮化硅、非晶氟聚合物、熱生長(二氧化硅)、旋涂(聚二甲基硅氧烷、光刻膠)等不同方法形成介質(zhì)層。疏水層一般是含氟聚合物(聚四氟乙烯),用于減少液滴驅(qū)動(dòng)的表面能。
表1 DMF芯片的種類及優(yōu)缺點(diǎn)

數(shù)字微流控的應(yīng)用
數(shù)字微流控技術(shù)作為一種通用性的新型離散微流體處理平臺(tái),擁有許多獨(dú)特優(yōu)勢(shì),因此在生物分析領(lǐng)域中得到了廣泛應(yīng)用。
基于核酸的應(yīng)用
分析DNA樣本或表征前,必須先進(jìn)行純化和提取。Sista等利用注塑成型的聚碳酸酯作為上板, PCB作為下板,使用首款集成型盒式雙平板DMF芯片從遺傳損傷樣本中提取出人類基因組DNA。首先,將全血液滴與含有細(xì)胞裂解液的液滴混合,然后引入含DNA捕獲磁珠的液滴將細(xì)胞溶解產(chǎn)物中的DNA捕獲,通過磁鐵的輔助分離出磁珠,用緩沖液反復(fù)清洗實(shí)現(xiàn)分離和純化。該款集成DMF芯片具有可自動(dòng)進(jìn)樣、易操作、反應(yīng)區(qū)大等優(yōu)點(diǎn),因此引起了廣泛關(guān)注。DMF設(shè)備也被用于DNA轉(zhuǎn)染反應(yīng),Madison等將Ti∶Au電穿孔電極集成于DMF芯片的下板上,通過脈沖放電的形式對(duì)混合后分別含質(zhì)粒DNA和大腸桿菌的液滴進(jìn)行電穿孔,從而使質(zhì)粒DNA轉(zhuǎn)染進(jìn)大腸桿菌體內(nèi)。這種基于DMF的電穿孔設(shè)備可實(shí)現(xiàn)多次自動(dòng)化的連續(xù)轉(zhuǎn)染,操作簡單、反應(yīng)快速,對(duì)于基因工程的亞微米尺度化發(fā)展起到了積極的作用。
聚合酶鏈?zhǔn)椒磻?yīng)(Polymerase chain reaction, PCR)是通過控制溫度和催化酶活性在不同溫度下完成三步循環(huán)反應(yīng)的過程,是分子生物學(xué)中最強(qiáng)有力的工具之一。2010年,Hua等發(fā)展了一種全自動(dòng)多通道DMF設(shè)備用于多路qPCR實(shí)驗(yàn),該設(shè)備使用集成型盒式DMF芯片(圖2A),并將反應(yīng)所需的溫度控制、磁響應(yīng)模塊和熒光檢測(cè)構(gòu)件等集成于系統(tǒng)中(圖2A左)。將在體外使用磁珠提取的耐甲氧西林金黃色葡萄球菌基因組DNA注入該裝置,可通過連續(xù)的磁珠富集、液滴移動(dòng)和混合操作使基因組DNA與PCR混合物混合,并利用液滴在兩個(gè)熱源之間的不斷運(yùn)動(dòng)實(shí)現(xiàn)溫度循環(huán)(圖2A右),即能夠?qū)崿F(xiàn)4路qPCR反應(yīng)的同時(shí)進(jìn)行。該系統(tǒng)利用DMF傳熱快、熱穩(wěn)定性好的優(yōu)勢(shì),通過簡單的液滴操縱實(shí)現(xiàn)了復(fù)雜的溫度循環(huán),且能檢測(cè)到相當(dāng)于低至單個(gè)細(xì)胞基因組的樣品量,同時(shí)擴(kuò)增效率達(dá)94. 7%以上。
將DMF應(yīng)用于DNA測(cè)序是一個(gè)新興的研究領(lǐng)域,而焦磷酸測(cè)序作為一種邊合成邊測(cè)序的方法,可通過連續(xù)的液滴混合分裂方式監(jiān)測(cè)其化學(xué)發(fā)光信號(hào)。Welch等利用簡單的T字型芯片結(jié)構(gòu)驗(yàn)證了DMF上的焦磷酸反應(yīng)實(shí)驗(yàn):在3個(gè)儲(chǔ)液槽中分別放置反應(yīng)所需的樣品、底物和酶,首先從儲(chǔ)液槽中分配出包含某一單一類型核苷酸底物和酶的液滴,并將其移至包含固定單段DNA樣品的位置。液滴孵化一段時(shí)間后將其移動(dòng)到CCD相機(jī)下觀測(cè)化學(xué)發(fā)光信號(hào),通過對(duì)磁珠的清洗即可進(jìn)行下一次的反應(yīng)。隨后,Boles等將該體系進(jìn)一步集成化,并進(jìn)行了DMF上的焦磷酸測(cè)序,在測(cè)序長度、測(cè)序精度和測(cè)序通量方面有了顯著提升。
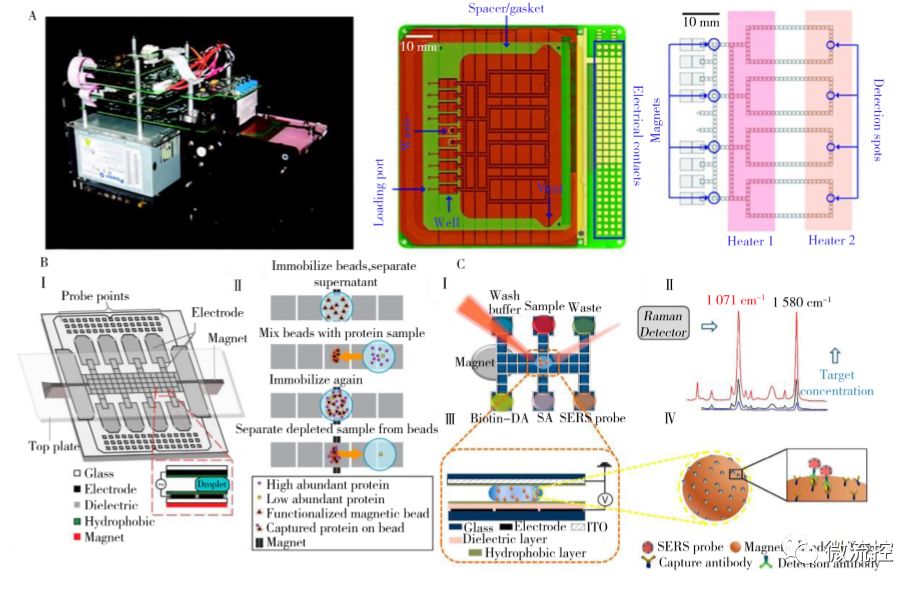
圖2 DMF在生物大分子研究中的應(yīng)用
A、一體化多路real-time PCR DMF芯片及設(shè)備;B、用于蛋白質(zhì)提取的具有自動(dòng)化磁分離體系的DMF芯片:(Ⅰ)磁鐵處于磁分離的位置時(shí)設(shè)備層的橫截面圖、(Ⅱ)DMF芯片上進(jìn)行自動(dòng)化蛋白質(zhì)提取的流程;C、SERS-DMF免疫分析原理:(Ⅰ)SERS-DMF芯片俯視圖、(Ⅱ)拉曼信號(hào)分子4-MBA特征峰、(Ⅲ)SERS-DMF芯片截面圖、(Ⅳ)帶SERS探針的免疫復(fù)合物結(jié)構(gòu)圖
蛋白質(zhì)組學(xué)
蛋白質(zhì)組學(xué)實(shí)驗(yàn)過程中,在利用質(zhì)譜或其他檢測(cè)器分析前通常需對(duì)大量樣本進(jìn)行多次處理,DMF具有的陣列式并行操控能力使其在蛋白質(zhì)組學(xué)研究領(lǐng)域獲得了廣泛應(yīng)用。早期主要使用DMF平臺(tái)用于復(fù)雜基質(zhì)中蛋白或多肽的純化,芯片結(jié)構(gòu)基本為無表面修飾的雙平板模式,在其上進(jìn)行多步的磁珠富集、清洗及液滴混合等基本操作即可完成實(shí)驗(yàn)。Mei等使用偶聯(lián)有anti-HSA、Protein A和Protein G的磁珠捕獲緩沖液中的人血漿蛋白,通過簡單的液滴混合和磁珠分離即可完成DMF上的自動(dòng)化蛋白質(zhì)提取(圖2B, Ⅰ)。該八通道芯片使用獨(dú)特的條狀磁棱鏡技術(shù),可在10min內(nèi)同時(shí)處理4個(gè)樣品,且IgG和HSA的提取效率達(dá)95%以上(圖2B, Ⅱ),使基質(zhì)輔助激光解吸附質(zhì)譜(MALDI-MS)的信噪比提升了近4倍,這種快速和自動(dòng)化的提取方法大大提高了樣品處理的集成度和樣品檢測(cè)的靈敏度。
免疫分析與臨床診斷
免疫分析是利用抗原和抗體的特異性反應(yīng)進(jìn)行檢測(cè),在臨床診斷和生化分析中具有廣泛應(yīng)用。 然而常規(guī)免疫分析耗時(shí)長、成本高、操作復(fù)雜,且檢測(cè)設(shè)備較大。而DMF技術(shù)具有的分析速度快、試劑和樣品用量少、易集成化和自動(dòng)化等特點(diǎn)在一定程度上能克服傳統(tǒng)免疫分析的缺點(diǎn)。Yang等設(shè)計(jì)了包裹有拉曼信號(hào)分子的核殼結(jié)構(gòu)納米顆粒Au@MBA@Ag,該顆粒具有表面增強(qiáng)拉曼信號(hào)放大功能,可作為酶聯(lián)免疫吸附體系ELISA中的信號(hào)輸出(圖2C, Ⅳ)。當(dāng)有靶標(biāo)流感病毒H5N1存在時(shí),修飾有捕獲抗體的磁珠和SERS顆粒的探針會(huì)與靶標(biāo)形成三明治結(jié)構(gòu),用緩沖液清洗未結(jié)合的納米顆粒后,將芯片置于拉曼檢測(cè)器下即可實(shí)現(xiàn)檢出(圖2C, Ⅱ)。該款芯片可將反應(yīng)試劑和反應(yīng)操作自動(dòng)化,并減小反應(yīng)試劑體積,實(shí)現(xiàn)了流感病毒H5N1的快速、靈敏和線上一體化分析,并能夠用于血清復(fù)雜樣本的直接高靈敏檢測(cè)(圖2C, Ⅰ、Ⅲ)。
臨床診斷相比于正常的免疫分析更加注重實(shí)際樣本的檢測(cè)能力與準(zhǔn)確度。Martin等首次證明了DMF芯片與生理體液的兼容性,建立了一種使用DMF在人類乳腺組織勻漿、全血和血清樣本中處理和提取雌激素的方法。該實(shí)驗(yàn)將樣本溶解使雌激素被提取到極性溶劑中,其他成分被提取到非極性溶劑中。從樣本中提取的雌激素用LC-MS和ELISA進(jìn)行監(jiān)測(cè)和量化,在提取量相同的條件下,該方法的樣本容量比傳統(tǒng)方法小1000倍,速度快20倍,因此有望用于乳腺癌的篩查與預(yù)診。Rackus等發(fā)展的紙基液體吸收預(yù)濃縮方法(P-CLIP)將高吸水能力的濾紙置于儲(chǔ)液槽中,在磁棱鏡控制捕獲有靶標(biāo)分子磁珠的情況下,將微升甚至毫升級(jí)的樣品拖動(dòng)至濾紙?zhí)帲ㄟ^其吸水能力使得樣品體積大幅減小,同時(shí)不損失樣品中的靶標(biāo)分子。該方法能夠完成大體積生理樣品的直接上樣分析,使得DMF的適用環(huán)境更加廣闊。
基于細(xì)胞的應(yīng)用
DMF由于具有可尋址性和高靈活性,相比傳統(tǒng)的微流控芯片更便于進(jìn)行各種細(xì)胞的培養(yǎng)和分析,因此被廣泛應(yīng)用于細(xì)胞相關(guān)領(lǐng)域的研究。Barbulovic-Nad等在2010年首次實(shí)現(xiàn)了芯片上哺乳動(dòng)物細(xì)胞的培養(yǎng),通過在上板疏水表面滴加纖連蛋白在芯片上得到局部親水的結(jié)構(gòu),當(dāng)液滴通過該結(jié)構(gòu)時(shí)會(huì)產(chǎn)生子液滴。使用該方法拖動(dòng)含有細(xì)胞的液滴,殘留于子液滴中的細(xì)胞沉降后即可貼附于芯片表面上,并完成細(xì)胞消化(圖3A, Ⅰ、Ⅱ)和換液(圖3A, Ⅲ、Ⅳ),培養(yǎng)時(shí)間長達(dá)5 d以上。Wit-ters等使用濕法Lift-Off技術(shù)改進(jìn)了DMF芯片上疏水化表面局部親水的方法,實(shí)現(xiàn)了結(jié)構(gòu)可控的DMF芯片上局部親水化圖案的制備,完成了DMF芯片上黏附細(xì)胞的單細(xì)胞、多細(xì)胞及細(xì)胞團(tuán)的表面固定(圖3B)。
近年來,隨著單細(xì)胞分析的快速發(fā)展,研究人員開始嘗試在DMF上進(jìn)行單細(xì)胞分析。Wheeler 等首次開發(fā)了基于DMF的免疫細(xì)胞化學(xué)平臺(tái),利用上板親水結(jié)構(gòu)捕獲細(xì)胞,然后引入試劑流經(jīng)細(xì)胞對(duì)其靶蛋白和磷酸化蛋白標(biāo)記,取下上板進(jìn)行后續(xù)的染色和微陣列掃描即可實(shí)現(xiàn)血小板來源生長因子受體(PDGFR)磷酸態(tài)的應(yīng)激響應(yīng)過程研究(圖3C)。2015年,Rival等將細(xì)胞懸液大量稀釋后直接生成液滴得到1~3 個(gè)細(xì)胞,利用磁珠捕獲實(shí)現(xiàn)了mRNA的捕獲、純化和一步 qRT-PCR,該方法使用多層光刻技術(shù)構(gòu)建了納升級(jí)的反應(yīng)體系,有望用于單細(xì)胞轉(zhuǎn)錄組測(cè)序文庫的制備(圖3D)。
總結(jié)與展望
本文總結(jié)了DMF技術(shù)的基本原理、芯片結(jié)構(gòu)及其在生物分析領(lǐng)域的應(yīng)用。DMF在諸多領(lǐng)域中均表現(xiàn)出明顯優(yōu)勢(shì),特別是在核酸處理、臨床診斷和細(xì)胞分析等方面,可在一個(gè)設(shè)備上完成復(fù) 雜樣品的預(yù)處理和高通量分析。隨著以PCB為基底的DMF芯片進(jìn)一步精良化、高通量化,以及可替換膜技術(shù)和快速打印技術(shù)的發(fā)展,DMF會(huì)變得更價(jià)廉、易得而且液滴驅(qū)動(dòng)、檢測(cè)和分離等新技術(shù)的不斷改進(jìn),也會(huì)對(duì)DMF的發(fā)展與集成起到促進(jìn)作用,使DMF設(shè)備變得更通用和集成, 更易于與其他儀器聯(lián)用。此外,由于DMF技術(shù)本身以模塊化和尋址性作為設(shè)計(jì)基礎(chǔ),因此可在一個(gè)芯片上通過軟件配置實(shí)現(xiàn)多靶標(biāo)的組合分析,有望在即時(shí)檢測(cè)領(lǐng)域得到進(jìn)一步的應(yīng)用。
然而,現(xiàn)階段DMF技術(shù)仍受制于加工成本高、技術(shù)要求高、穩(wěn)定性差等問題,使得其普及度低, 應(yīng)用場景有限。DMF設(shè)備的復(fù)雜制造過程和商業(yè)儀器的缺乏,也進(jìn)一步導(dǎo)致儀器使用度低,短時(shí)間內(nèi)難以快速推廣。盡管DMF技術(shù)不夠成熟,但仍在不斷改進(jìn),隨著大規(guī)模生產(chǎn)技術(shù)的發(fā)展和通用DMF儀器的發(fā)展,其在分析化學(xué)和其他領(lǐng)域?qū)⒂泻艽蟮陌l(fā)展?jié)摿Α?/p>
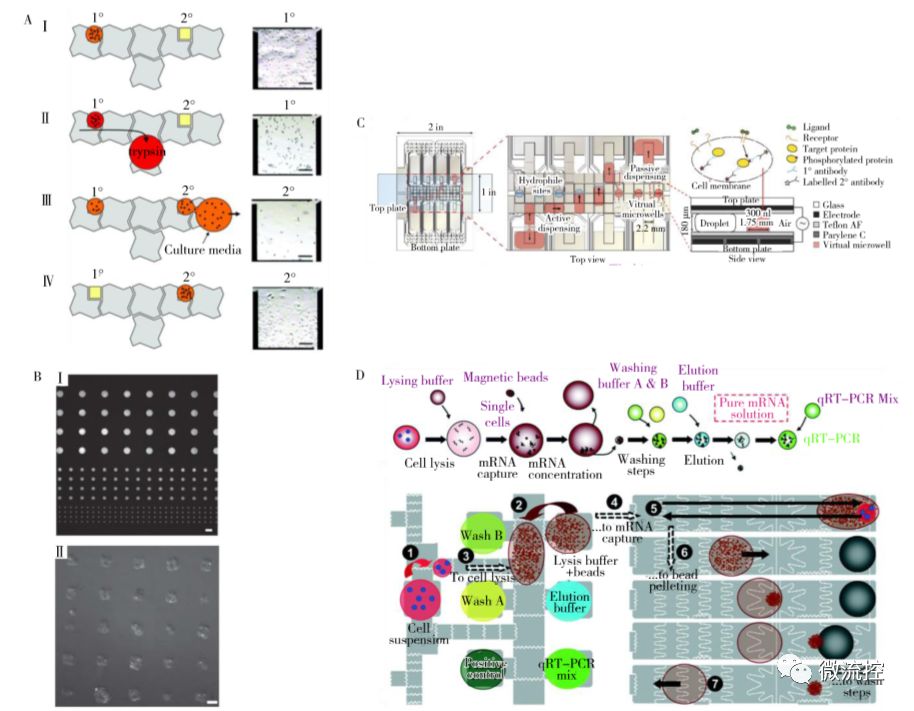
圖3 基于細(xì)胞的應(yīng)用
A、DMF上含CHO-K1細(xì)胞子液滴的形成及培養(yǎng);B、Teflon-AF表面FITC標(biāo)記的PLL熒光圖案;C、用于單細(xì)胞分析的DMF免疫細(xì)胞化學(xué)平臺(tái);D、DMF上單細(xì)胞用于基因表達(dá)分析的mRNA提取、純化和RT-PCR流程
-
芯片
+關(guān)注
關(guān)注
456文章
51027瀏覽量
425445 -
pcb
+關(guān)注
關(guān)注
4324文章
23137瀏覽量
398887 -
ITO
+關(guān)注
關(guān)注
0文章
55瀏覽量
19581
原文標(biāo)題:數(shù)字微流控技術(shù)及其在生物分析中的應(yīng)用
文章出處:【微信號(hào):MEMSensor,微信公眾號(hào):MEMS】歡迎添加關(guān)注!文章轉(zhuǎn)載請(qǐng)注明出處。
發(fā)布評(píng)論請(qǐng)先 登錄
相關(guān)推薦
技術(shù)解析:微流控芯片為什么這樣強(qiáng)大?
新技術(shù)在生物樣本冷凍中的應(yīng)用案例分析
微流控生物芯片的磁場仿真及實(shí)驗(yàn)對(duì)比
表面等離子共振技術(shù)在生物醫(yī)學(xué)中的應(yīng)用
微流控芯片技術(shù)詳解_微流控技術(shù)在生物醫(yī)學(xué)上的應(yīng)用
淺析微流控技術(shù)在生物傳感檢測(cè)領(lǐng)域的應(yīng)用
鎖相放大器在中微流控應(yīng)用的詳細(xì)說明
點(diǎn)成生物展出微流控芯片、壓力泵等產(chǎn)品,分享微流控芯片技術(shù)應(yīng)用方案

?綜述:基于類酶材料的微流控技術(shù)在生物分析方面的應(yīng)用
電壓放大器在液滴微流控芯片的功能研究中的應(yīng)用
電壓放大器在生物微流控中的應(yīng)用研究

優(yōu)可測(cè)推動(dòng)微流控技術(shù)革新,精準(zhǔn)助力生物醫(yī)學(xué)等行業(yè)的發(fā)展





 數(shù)字微流控技術(shù)的基本原理芯片結(jié)構(gòu)及在生物分析中的應(yīng)用說明
數(shù)字微流控技術(shù)的基本原理芯片結(jié)構(gòu)及在生物分析中的應(yīng)用說明










評(píng)論