微流控單細(xì)胞分析的意義
細(xì)胞是生命體結(jié)構(gòu)和功能的基本單位,是認(rèn)識(shí)一切生命現(xiàn)象的基礎(chǔ)和前提。傳統(tǒng)的基于細(xì)胞的生物學(xué)分析中,研究對(duì)象通常是數(shù)以十萬(wàn)至百萬(wàn)計(jì)的群細(xì)胞。隨著現(xiàn)代生物學(xué)的發(fā)展,這種傳統(tǒng)的細(xì)胞研究方式得到的“平均值”已經(jīng)不能滿足人們的需要,因?yàn)檠芯堪l(fā)現(xiàn)細(xì)胞間存在多樣性,或者說(shuō)是異質(zhì)性。從細(xì)菌到真核細(xì)胞,這種異質(zhì)性越發(fā)顯著。以腫瘤異質(zhì)性為例,研究人員發(fā)現(xiàn),同一種惡性腫瘤在不同患者個(gè)體間或者同一患體體內(nèi)的不同部位腫瘤細(xì)胞間均存在一定的差異,體現(xiàn)出惡性腫瘤的高度復(fù)雜性和多樣性。由此可見(jiàn),需要建立有效分析單個(gè)細(xì)胞的化學(xué)信息,亦或是測(cè)定單細(xì)胞對(duì)外界刺激的反應(yīng)的研究平臺(tái)。這不但能使人們更充分地了解細(xì)胞群體中某些特殊的細(xì)胞功能,更能鑒別大量細(xì)胞群體中少量的不正常細(xì)胞,為重大疾病的早期診斷和治療、藥物篩選和細(xì)胞間相互作用等研究提供可靠的科學(xué)依據(jù)。
盡管單細(xì)胞研究已被認(rèn)為是21世紀(jì)生命科學(xué)研究的重要突破口,但是將單個(gè)細(xì)胞作為分析對(duì)象時(shí),檢測(cè)平臺(tái)的構(gòu)建目前面臨以下4方面的巨大挑戰(zhàn):(1)由于單細(xì)胞體積小(微米級(jí)),胞內(nèi)分析物的尺寸更小(亞微米級(jí)甚至納米級(jí))且濃度極低,這就要求檢測(cè)平臺(tái)不但具有較強(qiáng)的分離與操控單個(gè)細(xì)胞的能力,而且應(yīng)當(dāng)具有較高的檢測(cè)靈敏度;(2)為了能夠有效地分析單細(xì)胞間的異質(zhì)性以及得到具有統(tǒng)計(jì)學(xué)意義的數(shù)據(jù),往往需要檢測(cè)平臺(tái)能夠同時(shí)分析大量單細(xì)胞,即具有高通量和快速檢測(cè)的能力;(3)在一些動(dòng)態(tài)觀察和分析單細(xì)胞的熒光、形態(tài)等研究需求中,檢測(cè)平臺(tái)應(yīng)當(dāng)具有實(shí)時(shí)顯微觀察的功能;(4)因需要分析與檢測(cè)的細(xì)胞數(shù)量通常很大,檢測(cè)及分析技術(shù)的開(kāi)發(fā)應(yīng)以簡(jiǎn)單易行、經(jīng)濟(jì)實(shí)惠為前提,以提高其在應(yīng)用時(shí)的普適性。
單細(xì)胞分析這一研究領(lǐng)域具有學(xué)科交叉性強(qiáng)的特點(diǎn),因此,在眾多諸如生物學(xué)、物理學(xué)、材料學(xué)及計(jì)算機(jī)學(xué)等領(lǐng)域的科研工作者的共同努力下發(fā)展了很多單細(xì) 胞分析技術(shù),包括流式細(xì)胞儀、熒光顯微成像技術(shù)和毛細(xì)管電泳技術(shù)等。這些技術(shù)的出現(xiàn)已經(jīng)使單細(xì)胞研究進(jìn)入到了分子結(jié)構(gòu)的水平,但是這些方法均存在著一 些不足。例如,雖然流式細(xì)胞術(shù)是目前用于高通量表征單個(gè)細(xì)胞活動(dòng)的最先進(jìn)的技術(shù),但它并不具有操控某個(gè)特定目標(biāo)細(xì)胞或者是動(dòng)態(tài)跟蹤觀察單個(gè)細(xì)胞的能力。而其他單細(xì)胞分析的方法,包括顯微成像、毛細(xì)管電泳等,雖然可以精準(zhǔn)分析單細(xì)胞的組分和結(jié)構(gòu),但是檢測(cè)通量較低。因此,為了滿足單細(xì)胞分析領(lǐng)域更高的研究需求,人們將目光轉(zhuǎn)向了微流控芯片這一新型操控及分析平臺(tái)。
微流控芯片(microfluidic chip),又稱芯片實(shí)驗(yàn)室(lab-on-a-chip, LOC),是一種以微機(jī)電技術(shù)為基礎(chǔ),以多維網(wǎng)絡(luò)微流道為結(jié)構(gòu)特征,目標(biāo)是將化學(xué)或生 物樣品的采集、稀釋、反應(yīng)、制備、檢測(cè)等基本操作步驟轉(zhuǎn)移和集成到很小的芯片上,最終實(shí)現(xiàn)常規(guī)化學(xué)或者生物實(shí)驗(yàn)室的微型化和集成化。微流控芯片不僅具有體積輕巧、樣品及試劑使用量少、操作速度快、通量高、應(yīng)用成本低等優(yōu)點(diǎn),更重要的是,這種集成化的微芯片式自動(dòng)分析平臺(tái)能夠有效避免人為操作產(chǎn)生的誤差,得到的數(shù)據(jù)可靠性更高。短短十幾年內(nèi),微流控芯片已經(jīng)成為最前沿的研究領(lǐng)域之一,特別是在與單細(xì)胞相關(guān)的研究中,微流控芯片被認(rèn)為是最具發(fā)展?jié)摿Φ母咄繂渭?xì)胞分析平臺(tái)。微流控芯片中微米級(jí)的二維或三維通道為單個(gè)細(xì)胞的操縱提供了尺寸相匹配的結(jié)構(gòu)。根據(jù)不同的研究需求,微流控芯片系統(tǒng)可將多種單細(xì)胞研究所需的操作單元,如細(xì)胞操縱相關(guān)的微泵、微閥技術(shù),單細(xì)胞捕獲技術(shù)以及檢測(cè)分析單元等設(shè)計(jì)并集成到微小的芯片平臺(tái)上。除此以外,微流控芯片的加工材料通常為聚二甲基硅氧烷(PDMS)及玻璃等,這類材料透明度高,生物相容性好,有助于單細(xì)胞的實(shí)時(shí)觀察與分析。綜上所述,相比傳統(tǒng)的單細(xì)胞分析方法,微流控芯片技術(shù)展現(xiàn)出巨大的應(yīng)用優(yōu)勢(shì),為單細(xì)胞相關(guān)的研究提供了更多的可能性。
微流控單細(xì)胞捕獲技術(shù)
在所有的微流控單細(xì)胞分析平臺(tái)開(kāi)發(fā)中,都要面臨單細(xì)胞捕獲的問(wèn)題,這主要指如何在微米級(jí)通道內(nèi)分離出單個(gè)細(xì)胞并將其固定在特定位置,以便于進(jìn)行后期操作與分析檢測(cè)。微流控芯片上的單細(xì)胞捕獲過(guò)程應(yīng)當(dāng)兼具操作簡(jiǎn)單高效和保證細(xì)胞活性的要求。目前已報(bào)道出多種微流控單細(xì)胞捕獲技術(shù),其中,基于流體動(dòng)力和液滴微流控的捕獲方法主要是通過(guò)合理地設(shè)計(jì)芯片中的微結(jié)構(gòu),使得當(dāng)細(xì)胞懸液以一定流速流過(guò)芯片時(shí),即可實(shí)現(xiàn)高通量的單細(xì)胞捕獲,捕獲過(guò)程不需要施加其他外力;而基于光、電、聲、磁的捕獲法則是需要借助外力的作用驅(qū)使細(xì)胞移動(dòng)到特定的捕獲位置,以實(shí)現(xiàn)高效、準(zhǔn)確的高通量單細(xì)胞捕獲。下面逐一介紹這些技術(shù)的原理和應(yīng)用,為單細(xì)胞分析相關(guān)領(lǐng)域的技術(shù)開(kāi)發(fā)提供參考。
流體力學(xué)捕獲法
流體力學(xué)捕獲法是通過(guò)微加工的方式在微流控芯片中制備剛性障礙微結(jié)構(gòu),從而可以將單個(gè)細(xì)胞從流動(dòng)的細(xì)胞懸液中分離捕獲的方式。該方法主要包括兩種捕獲思路:一種是微篩式結(jié)構(gòu),利用各種形狀的微擋板陣列攔截細(xì)胞,由于每個(gè)微擋板結(jié)構(gòu)只能攔截并容納單個(gè)細(xì)胞,因此當(dāng)細(xì)胞懸液流過(guò)后即可形成單細(xì)胞捕獲陣列;另一種是微坑式結(jié)構(gòu),主要是設(shè)計(jì)與單細(xì)胞尺寸相當(dāng)?shù)陌疾劢Y(jié)構(gòu)陣列,當(dāng)細(xì)胞懸液流過(guò)芯片時(shí),細(xì)胞因自身的重力落入凹槽陣列中,形成單細(xì)胞陣列,并且細(xì)胞在落入凹槽后,受到的流體沖擊力很小,捕獲的細(xì)胞不易被沖走。 Carlo等研究了一種U型高密度單細(xì)胞捕獲陣列(圖1(a)),當(dāng)細(xì)胞懸液流進(jìn)芯片的捕獲區(qū)域時(shí),其中一部分細(xì)胞會(huì)被卡在如圖1所示的這種“微壩”陣列處,最終形成高通量的單細(xì)胞捕獲陣列。Cooper等設(shè)計(jì)了一種如圖1(b)所示的包含有440個(gè)單細(xì)胞捕獲位點(diǎn)的微流控芯片,用于腫瘤單細(xì)胞的藥物動(dòng)力學(xué)研究,結(jié)果表明利用這種可視化的芯片平臺(tái)對(duì)細(xì)胞凋亡的有效評(píng)估可以與流式細(xì)胞儀相比擬。Voldman等設(shè)計(jì)了一種雙向凹陷的微結(jié)構(gòu)陣列,實(shí)現(xiàn)兩種單細(xì)胞的捕獲、配對(duì)和融合,如圖1(c)所示。當(dāng)一種細(xì)胞流過(guò)芯片時(shí),會(huì)在雙向凹陷微結(jié)構(gòu)的一面被捕獲,此時(shí)將溶液反向流過(guò)后,捕獲的細(xì)胞會(huì)被沖到另一面的凹陷中,然后再次進(jìn)樣捕獲另一種細(xì)胞,即可形成單細(xì)胞配對(duì)陣列,配對(duì)率達(dá)70%。Deutsch等在玻璃基底上通過(guò)刻蝕方式制備了高密度的蜂窩狀微坑陣列(圖1(d)),將細(xì)胞懸 液滴在陣列表面后蓋上蓋玻片,靜置幾分鐘后,細(xì)胞即可沉降落入微坑陣列中,形成單細(xì)胞陣列,而微坑的大小亦可根據(jù)細(xì)胞的種類不同而作相應(yīng)的調(diào)節(jié)。這種高通量的單細(xì)胞捕獲陣列的構(gòu)建使得多種進(jìn)一步的單細(xì)胞處理與分析,如熒光標(biāo)記、酶動(dòng)力學(xué)研究、胞內(nèi)組分分析等,均可實(shí)時(shí)在線完成。
(a)~(c)微篩式細(xì)胞捕獲陣列結(jié)構(gòu)示意圖及顯微圖片;(d)高密度蜂窩狀微坑細(xì)胞捕獲陣列
圖1 基于流體力學(xué)的微流控芯片上的單細(xì)胞操控
流體力學(xué)捕獲法操作過(guò)程簡(jiǎn)單,無(wú)需使用特殊的緩沖液,通過(guò)合理地設(shè)計(jì)芯片中微通道及與細(xì)胞尺寸相當(dāng)?shù)牟东@微結(jié)構(gòu),即可實(shí)現(xiàn)高通量的單細(xì)胞捕獲,并且固定的捕獲位點(diǎn)適合于單細(xì)胞的實(shí)時(shí)觀察和追蹤分析。但是這種方法的芯片通常加工難度較大,成本較高,并且在進(jìn)一步的單細(xì)胞分析中,可能會(huì)存在交叉污染的問(wèn)題。
液滴微流控捕獲法
利用液滴微流控法捕獲單細(xì)胞是在封閉的微通道網(wǎng)絡(luò)中生成納升至皮升級(jí)液滴并將單個(gè)細(xì)胞包裹在液滴中的技術(shù)。這一技術(shù)不僅可以短時(shí)間內(nèi)生成大量單細(xì)胞液滴,而且每個(gè)液滴皆可作為獨(dú)立的單細(xì)胞微反應(yīng)器,有效避免了交叉污染,最終可滿足多種單細(xì)胞的研究需求。目前,最常用于生成微液滴的方法T型通道法和十字型流體聚焦法,兩者都可以通過(guò)控制兩相流速來(lái)生成大小均一、性質(zhì)穩(wěn)定的液滴(圖2)。其中,T型通道結(jié)構(gòu)如圖2(a)所示,油相作為連續(xù)相,水作為分散相,分別從通道接口的兩端匯入,在表面張力與剪切力的共同作用下,分散相進(jìn)入連續(xù)相中形成分散的液滴。十字型流體聚焦芯片結(jié)構(gòu)如圖2(b)所示,中間流道的分散相受到兩邊連續(xù)相的“擠壓”,即可穩(wěn)定地形成連續(xù)分散的液滴,這種芯片結(jié)構(gòu)產(chǎn)生液滴的過(guò)程更易于操控,液滴尺寸更均勻,范圍也更廣。從生物相容性和保證細(xì)胞存活的角度來(lái)說(shuō),用于包裹細(xì)胞的液滴通常采用的是油包水的形式。
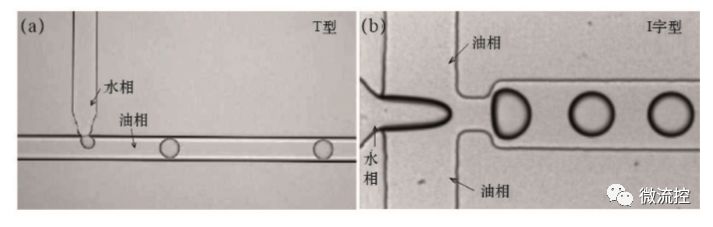
圖2 T型通道法(a)及十字型流體聚焦法;(b)生成液滴示意
Pan等報(bào)道了一種用于觀測(cè)單細(xì)胞的生長(zhǎng)增殖情況的液滴微流控芯片技術(shù)(圖3(a))。芯片的操作分為兩步,第一步是生成大量包裹著單細(xì)胞的微液滴,第二步則是將單細(xì)胞液滴取出進(jìn)行觀察和分析;在取出單細(xì)胞液滴放置于芯片內(nèi)后,細(xì)胞間的相對(duì)位置便不再會(huì)發(fā)生變化,可用于觀察單細(xì)胞隨著時(shí)間變化的增殖情況及細(xì)胞間的差異的研究。Novak等用瓊脂糖液滴微流控技術(shù)進(jìn)行了高通量的單細(xì)胞基因分析。他們先用瓊脂糖液滴將細(xì)胞和包含有引物的微球一同包裹在微液滴內(nèi)(圖3(b)),在細(xì)胞被裂解后基因組DNA則被留在了液滴內(nèi),隨后將液滴與聚合酶鏈?zhǔn)椒磻?yīng)(PCR)所需的反應(yīng)物進(jìn)行孵育,可直接在液滴內(nèi)進(jìn)行PCR,最后將微球提取出來(lái)進(jìn)行高通量的流式分析和DNA測(cè)序。值得一提的是,目前已經(jīng)有不少公司開(kāi)發(fā)了基于液滴微流控芯片技術(shù)的檢測(cè)分析儀器,比如,英國(guó)Dolomite公司開(kāi)發(fā)的液滴微流控系統(tǒng)可以在微流控芯片上快速生成大量尺寸可控、單分散性好的微液滴,液滴內(nèi)部可以再包含更小的液滴,且外部和內(nèi)部的微液滴在大小和形狀上都具有很好的一致性,為單細(xì)胞測(cè)序以及單細(xì)胞間相互作用等分析領(lǐng)域的研究提供了一種穩(wěn)定、高效的多功能分析平臺(tái)。美國(guó)10XGenom-ics公司基于液滴微流控的原理設(shè)計(jì)開(kāi)發(fā)了高通量單細(xì)胞轉(zhuǎn)錄組測(cè)序平臺(tái),可同時(shí)獲得103~104個(gè)細(xì)胞的表達(dá)信息,從而實(shí)現(xiàn)對(duì)細(xì)胞群體的劃分與細(xì)胞群體間基因表達(dá)差異的檢測(cè),也為腫瘤細(xì)胞異質(zhì)性,免疫細(xì)胞群體檢測(cè)以及胚胎發(fā)育等眾多研究領(lǐng)域提供了技術(shù)平臺(tái)。基于液滴微流控的單細(xì)胞捕獲芯片加工成本低,消耗試劑和樣品量少,捕獲速度快,特別適合于需要將單細(xì)胞和其他試劑獨(dú)立包裹在微液滴中進(jìn)行單細(xì)胞分析的研究中,但是這種方法常存在單個(gè)液滴中無(wú)細(xì)胞包裹或多個(gè)細(xì)胞包裹的情況,并且包裹單細(xì)胞后的微液滴位置難以固定,不太適合特定單細(xì)胞的實(shí)時(shí)觀察。
圖3 微流控液滴生成與單細(xì)胞包裹圖
單光束激光捕獲法
單光束激光捕獲技術(shù),又稱為光鑷,是一種可以通過(guò)高度匯聚的激光束形成三維勢(shì)阱,并利用束腰附近存在強(qiáng)大的梯度力捕獲并移動(dòng)單個(gè)細(xì)胞的技術(shù)(圖4 (a))。如圖4(b)所示,通過(guò)光束的調(diào)控,光鑷能夠精準(zhǔn)地捕獲一群細(xì)胞中的單個(gè)或多個(gè)目標(biāo)細(xì)胞,并將其移動(dòng)到特定的位置便于分析檢測(cè)。再如,光鑷可作為細(xì)胞融合的有效工具,將激光捕獲的2個(gè)細(xì)胞緊密接觸再融合,能使對(duì)細(xì)胞的損傷降至最低,也不會(huì)產(chǎn)生不期望的融合物(圖4(c))。進(jìn)一步地,光鑷不僅可以精準(zhǔn)地操控微米級(jí)的單個(gè)細(xì)胞,可以利用光束的穿透性實(shí)現(xiàn)對(duì)細(xì)胞內(nèi)部各種尺寸更小的細(xì)胞器進(jìn)行操縱。
圖4 基于光鑷技術(shù)的微流控芯片中的單細(xì)胞捕獲
光鑷捕獲技術(shù)在單細(xì)胞的操控方面擁有獨(dú)特的優(yōu)勢(shì),光鑷具有微米級(jí)范圍定位的能力,能夠精確地捕獲和移動(dòng)單個(gè)細(xì)胞,而且光鑷不需要接觸細(xì)胞,因此整個(gè)操作甚至可以在完全密封的容器里進(jìn)行,不會(huì)損傷細(xì)胞,污染少。但是,光鑷需要的設(shè)備要求較高,價(jià)格昂貴,并且不太適合應(yīng)用于高通量的單細(xì)胞捕獲和分析領(lǐng)域。
介電電泳捕獲法
介電電泳現(xiàn)象由Pohl在1951年首先發(fā)現(xiàn),描述的是非均勻電場(chǎng)中介電粒子被極化而受力產(chǎn)生的定向移動(dòng)。如圖5所示,在不同的電極結(jié)構(gòu)產(chǎn)生的不同的非均勻電場(chǎng)中,介電粒子會(huì)受正介電電泳力(p-DEP)作用向高電場(chǎng)或者受負(fù)介電電泳力(n-DEP)作用向低電場(chǎng)運(yùn)動(dòng),最終在不同的位置被捕獲固定,從而實(shí)現(xiàn)粒子 的有效操控。同樣地,作為介電粒子的細(xì)胞被置于非均勻電場(chǎng)中時(shí),只需通過(guò)改變施加電壓的大小和頻率等條件,細(xì)胞即可根據(jù)其所受到的介電電泳力進(jìn)行移 動(dòng)。近年來(lái),研究人員將基于介電電泳的細(xì)胞操縱技術(shù)與微流控芯片技術(shù)相結(jié)合,得到了一系列高效可靠的單細(xì)胞研究平臺(tái)。
圖5 不同電極結(jié)構(gòu)產(chǎn)生的非均勻電場(chǎng)中受正介電力和負(fù)介電力的粒子捕獲示意
Hunt等開(kāi)發(fā)了一種“介電電泳鑷”(圖6(a)),將微電極制備在玻璃毛細(xì)管的針尖兩側(cè),通過(guò)調(diào)整電壓、頻率等參數(shù),可以靈活實(shí)現(xiàn)單個(gè)細(xì)胞的捕獲、釋放、移動(dòng)等多種操控,但是每次只能對(duì)一個(gè)細(xì)胞進(jìn)行分析,通量較低。Voldman等利用微加工技術(shù)制備了8組三維柱狀電極陣列(圖6(b)),每組分別包含4個(gè)微柱狀電極,并可作為一個(gè)獨(dú)立的單細(xì)胞操控單元,通過(guò)調(diào)節(jié)施加電壓的參數(shù),可以利用介電電泳力選擇性地捕獲單細(xì)胞,而在斷電后,捕獲的單細(xì)胞會(huì)被釋放。Cheng等建立了一種平面式的基于介電電泳技術(shù)的高通量單細(xì)胞配對(duì)微流控芯片平臺(tái)(圖6(c)),兩種細(xì)胞懸液先后流經(jīng)微流控芯片并受強(qiáng)介電電泳力的作用被捕獲進(jìn)入微孔陣列中,最終在1cm×1.5cm的捕獲區(qū)域完成了超過(guò)2400對(duì)的單細(xì)胞配對(duì),配對(duì)效率達(dá)70%以上,這種高通量單細(xì)胞配對(duì)芯片有望應(yīng)用于細(xì)胞的精準(zhǔn)融合,細(xì)胞-細(xì)胞間相互作用等研究領(lǐng)域中。
圖6 基于介電電泳技術(shù)的微流控芯片上的單細(xì)胞捕獲
基于介電電泳技術(shù)的單細(xì)胞捕獲法具有操作簡(jiǎn)單靈活、捕獲效率高、對(duì)細(xì)胞損傷小以及可實(shí)時(shí)觀察等優(yōu)點(diǎn)。但是,這一捕獲法通常需要使用特殊的緩沖液,合理地設(shè)計(jì)電極結(jié)構(gòu)及分析細(xì)胞受到的介電電泳力,對(duì)保證細(xì)胞的活性和實(shí)現(xiàn)高效的單細(xì)胞捕獲至關(guān)重要。
聲捕獲法
通過(guò)聲波結(jié)合微流控芯片進(jìn)行細(xì)胞操控的方法,是指在芯片上施加一定的聲場(chǎng),使芯片通道內(nèi)的細(xì)胞受到聲波力的作用驅(qū)使細(xì)胞遷移至特定位置。用于細(xì)胞操控的聲波分為體聲波駐波和聲表面駐波兩類。體聲波駐波操控細(xì)胞的原理是當(dāng)超聲駐波激發(fā)微流體通道產(chǎn)生共振時(shí),通道內(nèi)的細(xì)胞由于大小、質(zhì)量、密度等物理性質(zhì)的不同,將受到不同的聲波力的作用,從而可以將不同種類的細(xì)胞分成幾股液流,實(shí)現(xiàn)理想的細(xì)胞分離富集的預(yù)處理過(guò)程。Laurell等利用這種技術(shù)成功完成了血液清洗過(guò)程(圖7(a))。另一種聲表面駐波裝置,又稱為聲鑷,通過(guò)在微流控通道周圍放置叉指換能器用于形成表面駐波。在聲表面駐波的作用下,細(xì)胞將受到機(jī)械擾動(dòng)并沿著流體上清晰的流線移動(dòng)。與體駐波相比,聲表面駐波裝置可以提供的頻率范圍較大,更加有利于單個(gè)細(xì)胞的靈活操控,即能快速地將單個(gè)細(xì)胞捕獲在精確位置,而且細(xì)胞的活性不受影響,這一技術(shù)在微流控單細(xì)胞操控領(lǐng)域受到越來(lái)越多的關(guān)注。Huang等開(kāi)發(fā)了一種利用聲表面駐波裝置實(shí)現(xiàn)高通量單細(xì)胞操控的微流控芯片,如圖7(b)所示。他們構(gòu)建的聲學(xué)裝置包含了兩對(duì)產(chǎn)生聲波的叉指換能器。當(dāng)兩股聲波在微通道內(nèi)相遇時(shí),形成的駐波會(huì)產(chǎn)生一系列的壓力節(jié)點(diǎn),細(xì)胞在壓力節(jié)點(diǎn)處可被捕獲,并且通過(guò)調(diào)節(jié)聲波波長(zhǎng)和相位,可以移動(dòng)壓力節(jié)點(diǎn)從而靈活控制單細(xì)胞的捕獲位置。
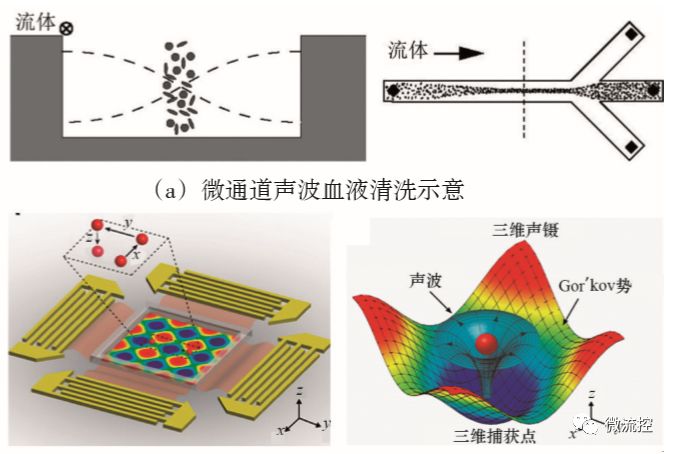
圖7 基于聲波技術(shù)的微流控芯片上的細(xì)胞操控
聲表面駐波技術(shù)能實(shí)現(xiàn)無(wú)接觸、快速簡(jiǎn)便的高通量單細(xì)胞捕獲,且用于捕獲的聲波能量對(duì)細(xì)胞無(wú)傷害,芯片制作較為簡(jiǎn)單。與介電電泳技術(shù)類似,該技術(shù)對(duì)產(chǎn)生聲表面駐波的裝置的設(shè)計(jì)、制作及控制要求較高。
磁捕獲法
磁捕獲技術(shù)的工作原理是目標(biāo)細(xì)胞與磁性微球發(fā)生非特異性或特異性吸附后,利用外加磁場(chǎng)的作用可以實(shí)現(xiàn)目標(biāo)細(xì)胞的捕獲和排列。以基于腫瘤表面標(biāo)志物的磁捕獲技術(shù)為例,目前大多數(shù)癌細(xì)胞表面具有一種叫上皮細(xì)胞黏附因子(epithelial cell adhesion mole-cule, EpCAM)的蛋白質(zhì),通過(guò)在磁珠表面包被Anti-Ep-CAM抗體,即可與目標(biāo)癌細(xì)胞發(fā)生特異性結(jié)合,形成磁珠-細(xì)胞的復(fù)合物,然后在外加磁場(chǎng)的作用下,復(fù)合物受磁力作用被分離捕獲。Chan等將單個(gè)細(xì)胞包裹在一種雙色磁性微球中(圖8(a)),通過(guò)外加磁場(chǎng)操控雙色球,可以實(shí)現(xiàn)對(duì)單個(gè)細(xì)胞的操控。Kang等報(bào)道了一種基于磁珠捕獲技術(shù)的循環(huán)腫瘤細(xì)胞(CTCs)分離微流控芯片,如圖8(b)所示。芯片內(nèi)包含有主通道以及通道兩邊的側(cè)腔結(jié)構(gòu),側(cè)腔內(nèi)集成有磁鐵。他們以摻有少量乳腺癌細(xì)胞的小鼠血液作為樣本驗(yàn)證器件的性能,癌細(xì)胞的表面吸附有磁珠,即當(dāng)這種血液樣本流入芯片后,帶有磁珠的癌細(xì)胞會(huì)在磁場(chǎng)的作用下被捕獲入側(cè)腔結(jié)構(gòu)中,最終實(shí)現(xiàn)了90%的捕獲效率,并且捕獲得到的癌細(xì)胞能夠存活7天。
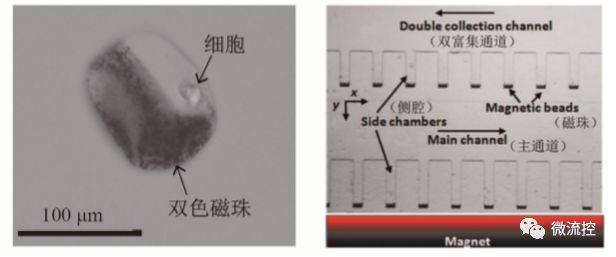
(a)雙色磁珠包裹單細(xì)胞圖片;(b)微磁-微流控CTCs分離芯片
圖8 基于磁捕獲技術(shù)的微流控芯片上的細(xì)胞操控
總體來(lái)說(shuō),磁捕獲技術(shù)對(duì)芯片結(jié)構(gòu)設(shè)計(jì)的要求不高,細(xì)胞捕獲也不需要復(fù)雜的外部設(shè)備。但是,捕獲操作之前需要先對(duì)細(xì)胞進(jìn)行磁性粒子修飾,而且在基于抗原-抗體識(shí)別的免疫磁珠捕獲技術(shù)中往往還存在著抗體容易失活、價(jià)格昂貴、反應(yīng)條件苛刻等一系列的缺陷,從而限制了其實(shí)際應(yīng)用。
結(jié)論
經(jīng)過(guò)多年的發(fā)展,微流控單細(xì)胞捕獲技術(shù)已經(jīng)廣泛應(yīng)用于單細(xì)胞相關(guān)領(lǐng)域的研究中,為進(jìn)一步的單細(xì)胞生物學(xué)的研究提供了有力的保障。雖然目前這些微流控芯片單細(xì)胞捕獲方法多樣且有效,但是每種方法本身都存在一些不足。例如接觸式方法如液滴微流控技術(shù)設(shè)備簡(jiǎn)單,但是往往捕獲效率不高;借助外力的非接觸式的捕獲方法操作溫和、效率高,但通常需要集成外部復(fù)雜的設(shè)備。因此,合理有效地結(jié)合多種微流控單細(xì)胞捕獲手段,最終發(fā)展更為簡(jiǎn)單高效的單細(xì)胞捕獲技術(shù),不僅能夠增強(qiáng)其在普通實(shí)驗(yàn)室中的實(shí)用性,更為單細(xì)胞分析提供了更可靠的研究平臺(tái)。
-
芯片
+關(guān)注
關(guān)注
455文章
50816瀏覽量
423619 -
細(xì)胞
+關(guān)注
關(guān)注
0文章
66瀏覽量
18334 -
微流控
+關(guān)注
關(guān)注
16文章
529瀏覽量
18896
原文標(biāo)題:微流控芯片在單細(xì)胞捕獲中的應(yīng)用
文章出處:【微信號(hào):MEMSensor,微信公眾號(hào):MEMS】歡迎添加關(guān)注!文章轉(zhuǎn)載請(qǐng)注明出處。
發(fā)布評(píng)論請(qǐng)先 登錄
相關(guān)推薦
常用的微流控芯片類型
基于磁珠操控的微流控平臺(tái)實(shí)現(xiàn)副溶血性弧菌的快速捕獲與檢測(cè)
基于介電電泳的選擇性液滴萃取微流體裝置用于單細(xì)胞分析
微流控陣列芯片和普通芯片的區(qū)別
ATA-7020高壓放大器在微流控3D細(xì)胞微球培養(yǎng)中的應(yīng)用
微流控芯片在生物學(xué)有何應(yīng)用?微流控芯片微液滴、檢測(cè)技術(shù)介紹
寬帶功率放大器基于微流控技術(shù)的細(xì)胞分選的應(yīng)用
一種用于微液滴中單細(xì)胞無(wú)標(biāo)記分析的液滴篩選(LSDS)方法
微流控芯片技術(shù)的特點(diǎn) 微流控芯片與生物芯片的區(qū)別
基于雙極性電極陣列的微流控芯片,可實(shí)現(xiàn)細(xì)胞可控、非接觸三維旋轉(zhuǎn)

安泰ATA-7050高壓放大器在微流控細(xì)胞分選中的應(yīng)用
基于雙極性電極的微流控芯片,用于生物顆粒和細(xì)胞分選




 微流控芯片在單細(xì)胞捕獲中的應(yīng)用
微流控芯片在單細(xì)胞捕獲中的應(yīng)用










評(píng)論