電解池的設計及標準
電解池的主要應用用于工業制純度高的金屬,是將電能轉化為化學能的一個裝置(構成:外加電源,電解質溶液,陰陽電極)。使電流通過電解質溶液或熔融電解質而在陰,陽兩極引起還原氧化反應的過程。
1. 電解池設計的一些標準
1) 電解池體積
體積要適當,同時要選擇適當的工作電極和溶液體積之比,在多數電化學測量中,需要保證溶液本體濃度不隨反應的進行而改變,這時就要采用小的工作電極與溶液體積之比;在有些測試中電解液有限,那就只能盡量減小電解池的體積;在某些測量中,如電解分析中,為了盡可能短時間內使溶液中反應物電解反應完畢,應使用足夠大的研究電極面積和溶液體積之比。因此要根據具體情況確定溶液體積,選擇合適的電解池。
2) 電解池材質
玻璃是常用的電池材料,其在大多數無機溶液或有機溶液中都很穩定,但是在HF溶液、濃堿中不是很穩定,此時可以用聚四氟乙烯,它具有很好的化學穩定性,在濃堿與王水中均不發生變化,同時也不溶于有機溶劑,使用溫度范圍-195 ℃~250 ℃。
3) 電解池用隔膜
工作電極和輔助電極體系之間的電流密度盡量能夠分布均勻(特別是對于精細的電化學實驗),所以兩個電極最好是平面且是對著的。在工作電極和輔助電極之前常用多孔玻璃隔開(即多室電解槽),一方面能夠得到均勻的電流分布,此外也能減少輔助電極上的反應對工作電極的影響,其弊端是在一定程度上也增加了溶液電阻。
4) 電解質
一般電極反應在溶液中或在熔融鹽(如提取鋁)中發生。為了減小電場作用下電活性物質的遷移現象,加入高濃度的不參加電極反應的電解質是非常必要的,稱為惰性電解質或支持電解質。電解質的濃度至少是電活性物質濃度的100倍,成為導電的主要離子。電解質可以是無機鹽也可以是有機鹽,酸或堿,或緩沖溶液(如檸檬酸鹽、磷酸鹽、醋酸鹽等)。
某些支持電解質在水解溶液和部分非水溶液中的近似使用電勢范圍
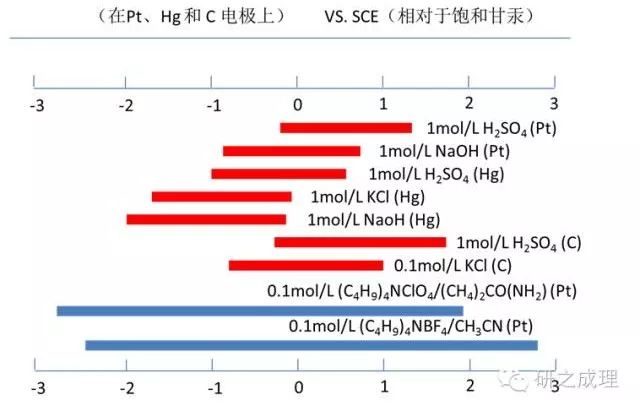
上圖給出了部分水溶劑和非水溶劑中某些有用的支持電解質。溶劑和支持電解質使用的電勢范圍,在一定程度上其值也與所使用的電極材料有關,也即我們常說的電化學勢窗。所有的情況必須保證支持電解質在實驗所使用的電勢范圍內是惰性的,不能與電極或電極反應產物發生反應。在進行電化學測試前,必須進行potential window的確定,以防干擾電化學測量或損壞電極。
5) 電解池通氣裝置
很多電化學測量需要使用惰性氣體除氧或特異性吸附某些氣體(如CO、H2S、O2),電解池需要有進氣和出氣通道,進氣管口應該在電解池底部,常接有燒結玻璃,使進入的氣體變成小氣泡,更易分散,出氣口有水封,防止空氣進入,或在實驗過程中改為在溶液上方通氣,防止氣體干擾到實驗的進行,又起到保護氣的作用。
6) 電解池用鹽橋
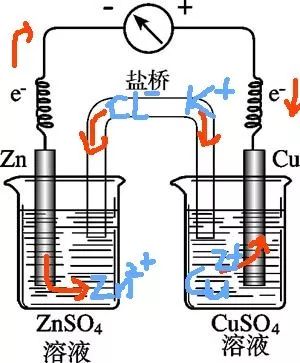
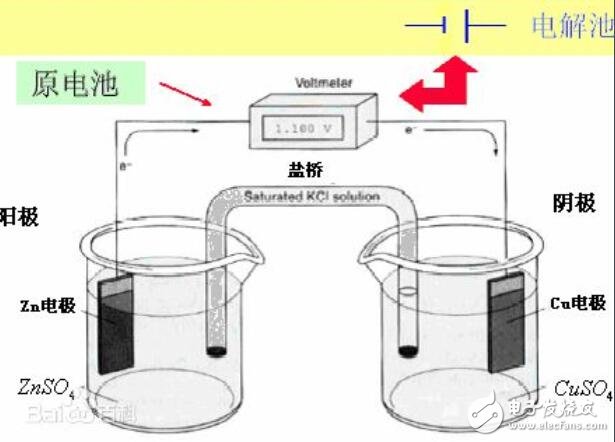
當被測電極體系的溶液與參比電極的溶液不同時,常用鹽橋把參比電極和研究電極連接起來,可使它們之間形成離子導電通路。鹽橋作用有兩個:一個是減小液接電位;二是防止或減少研究和參比電極的溶液之間的相互污染。常用的鹽橋的電解質是KCl,為了防止其他離子與Cl離子反應,也可用KNO3。一般用瓊脂固定,做成U型,保存在飽和的鹽橋內置溶液中。
7) 電解池用魯金毛細管
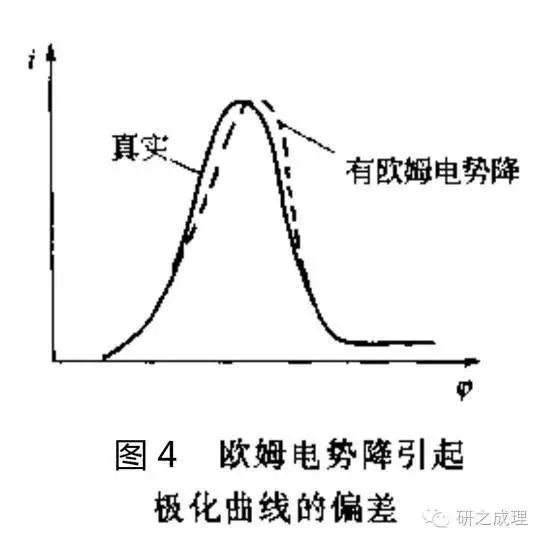
根據參比電極測量電位的原理我們可知,為了精確控制工作電極上的電勢,參比和工作電極之間的電阻要盡量小,這時可以用魯金毛細管。魯金毛細管由玻璃管或塑料管做成,其一端拉得很細,極化測量中將此靠近被測量電極,另一端與參比電極相通。魯金毛細管的位置不同,測得的工作電極的電位會略有差別,因為在工作電極和參比電極的毛細管之間,由極化電流和這段溶液電阻引起的歐姆電勢降會附加到測量或控制的電勢中去,造成誤差(如圖4)。所以毛細管口要盡量靠近工作電極,但也不能無限靠近,以防對工作電極表面的電力線分布造成屏蔽效應,一般情況下可將毛細管間端外徑拉到0.5~0.1mm,使其尖嘴離工作電極表面的距離不小于毛細管間端外徑。
2. 電解池的種類
在進行電化學測試前,電解池的設計是重要的一步,它直接影響到測試結果的準確性,電解池一般是指進行電化學測試的容器。電解池的設計種類繁多,關鍵是選擇一款適合自己體系的電解池。常見的電解池如下圖所示,它適合一般的電化學測試用。
按照電解槽中的研究電極和輔助電極是否隔開,可將電解槽分為單室電解槽(下圖1)和雙室電解槽(下圖2)。像圖1是一種用于腐蝕研究的單室電解池;圖2是一種H型電解池,它將工作電極和輔助電極用隔膜隔開,可以有效防止在測試過程中輔助電極的產物對工作電極的影響。
根據電解時生成物的情況,電解可分以下幾種類型:1.電解水型:含氧酸、強堿、活潑金屬的含氧酸鹽溶液的電解;2.分解電解質型:無氧酸(如HC1)、不活潑金屬的無氧酸鹽(如CuCl2)溶液的電解;3.放氫生堿型:活潑金屬的無氧酸鹽(如NaCl、MgBr2等)溶液的電解;4.放氧生酸型:不活潑金屬的含氧酸鹽(如CuSO4、AgNO3等)溶液的電解。
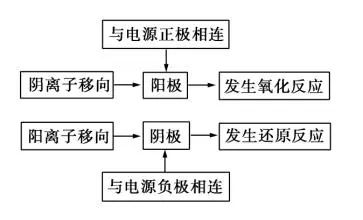
電解過程中的能量轉化(裝置特點) 陰極:一定不參與反應 不一定惰性電極 陽極:不一定參與反應 也不一定是惰性電極發生電解反應的條件 ①連接直流電源 ②陰陽電極 陰極:與電源負極相連為陰極 陽極:與電源正極相連為陽極 ③兩極處于電解質溶液或熔融電解質中 ④兩電極形成閉合回路
電化學重要公式及應用舉例
1. 法拉第定律

對于法拉第電解定律,在實際中常常用到的是計算法拉第效率,也即施加的電流用于某一個電化學反應的比例。法拉第效率往往能反映出材料的選擇性。
應用舉例:圖B給出了在CO2電還原中CO和H2的法拉第效率,在低電位下該材料對CO的選擇性是很高的,到了高電位H2逐漸占據主導。兩者相加大約是90%,那么如果認為總法拉第效率是100%,剩下的10%基本可歸結為HCOOH,CH3OH等液體產物。S12給出了計算法拉第效率的公式。
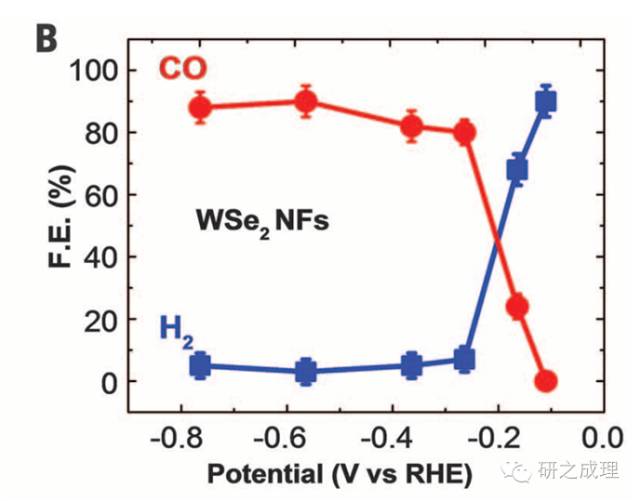
(B)CO and H2overall faradaic efficiency (FE) at different applied potentials for WSe2NFs.The error bars represent SD of four measurements.

參考文獻:Asadi M, Kim K, Liu C, et al. Nanostructured transition metal dichalcogenide electrocatalysts for CO2 reduction in ionic liquid. Science 2016, 353(6298): 467-470.
2. 能斯特方程

由于Butler-Volmer方程和能斯特方程有一定的統一性,這里也介紹下B-V方程。


因此,對于能斯特方程,只有在動力學為0,即平衡狀態下才試用。由于參比電極本身是個可逆性很高的電極,所以在實際中常常用能斯特方程來進行參比電極之間的換算。
應用舉例:參比電極之間的換算。為了能與不同文獻有對比性,往往我們會將相對參比電極的電勢歸一化到相對可逆氫電極的電勢,而我們在做電化學實驗的時候用的參比電極往往不是可逆氫電極,這時,我們就需要把實際測出來的電位換算到相對于可逆氫電極的電位。
還是上面那篇文獻,實際用的是Ag/AgCl電極,需要轉換成可逆氫電極RHE,supporting information給出了轉換式子:

推導:
由于PH會影響RHE的電極電勢,所以需要先對氫電極進行轉化:

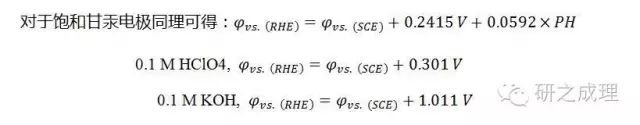
3. 塔菲爾公式
塔菲爾公式的數學表達式為: η=a+blogj
式中過電位和電流密度j均取絕對值(即正值),a和b稱為塔菲爾常數,它的大小和電極材料的性質、電極表面狀態、溶液組成及溫度等因素有關,根據塔菲爾斜率的大小,可以比較不同電極體系中進行電子轉移步驟的難易程度。
塔菲爾公式與B-V方程:

應用舉例:塔菲爾曲線在電化學析氧中應用非常廣泛,對于確定電子步驟的難易程度具有重要的價值。俄勒岡大學Boettcher課題組的J. Am. Chem. Soc., 2015, 137 (10),3638–3648一文中對于這個應用做了詳細討論:

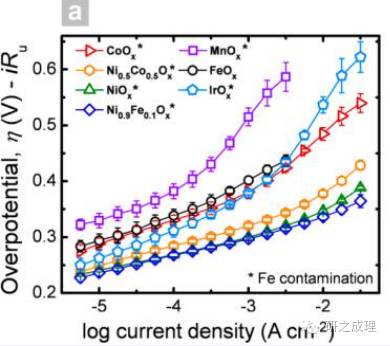
另一個方面,塔菲爾曲線也是一個直觀地判別電催化劑活性的依據,對于OER而言,一般Tafel斜率越小,說明其活性越好,如下圖所示,越靠向右下角的催化劑其活性越好(相同電流下過電位低)
-
化學
+關注
關注
1文章
83瀏覽量
19435 -
電解池
+關注
關注
0文章
24瀏覽量
9537
原文標題:【干貨】電化學基礎知識系列(三):電解池的設計及標準與電化學重要公式及應用舉例
文章出處:【微信號:Recycle-Li-Battery,微信公眾號:鋰電聯盟會長】歡迎添加關注!文章轉載請注明出處。
發布評論請先 登錄
相關推薦




 電解池的設計及標準與電化學重要公式及應用舉例
電解池的設計及標準與電化學重要公式及應用舉例










評論