鉛酸電池(VRLA),是一種電極主要由鉛及其氧化物制成,電解液是硫酸溶液的蓄電池。鉛酸電池放電狀態(tài)下,正極主要成分為二氧化鉛,負(fù)極主要成分為鉛;充電狀態(tài)下,正負(fù)極的主要成分均為硫酸鉛。
一個(gè)單格鉛酸電池的標(biāo)稱電壓是2.0V,能放電到1.5V,能充電到2.4V;在應(yīng)用中,經(jīng)常用6個(gè)單格鉛酸電池串聯(lián)起來組成標(biāo)稱是12V的鉛酸電池,還有24V、36V、48V等。
鉛酸蓄電池電動(dòng)勢(shì)的產(chǎn)生
(1)鉛酸蓄電池充電后,正極板是二氧化鉛(PbO2),在硫酸溶液中水分子的作用下,少量二氧化鉛與水天生可離解的不穩(wěn)定物質(zhì)—?dú)溲趸U(Pb(OH)4),氫氧根離子在溶液中,鉛離子(Pb)留在正極板上,故正極板上缺少電子。
(2)鉛酸蓄電池充電后,負(fù)極板是鉛(Pb),與電解液中的硫酸(H2SO4)發(fā)生反應(yīng),變成鉛離子(Pb2),鉛離子轉(zhuǎn)移到電解液中,負(fù)極板上留下多的兩個(gè)電子(2e)。
(3)可見,在未接通外電路時(shí)(電池開路),由于化學(xué)作用,正極板上缺少電子,福極板上多余電子,兩極板見就產(chǎn)生了一定的電位差,這就是電池的電動(dòng)勢(shì)。
鉛酸蓄電池放電過程的電化反應(yīng)
(1)鉛酸蓄電池放電時(shí),在蓄電池的電位差作用下,負(fù)極板上的電子經(jīng)負(fù)載進(jìn)進(jìn)正極板形成電流I。同時(shí)在電池內(nèi)部進(jìn)行化學(xué)反應(yīng)。
(2)負(fù)極板上每個(gè)鉛原子放出兩個(gè)電子后,天生的鉛離子(Pb2)與電解液中的硫酸根離子(SO4?2)反應(yīng),在極板上天生難溶的硫酸鉛(PbSO4)。
(3)正極板的鉛離子(Pb4)得到來自負(fù)極的兩個(gè)電子(2e)后,變成二價(jià)鉛離子(Pb2)與電解液中的硫酸根離子(SO4?2)反應(yīng),在極板上天生難溶的硫酸鉛(PbSO4)。正極板水解出的氧離子(O?2)與電解液中的氫離子(H)反應(yīng),天生穩(wěn)定物質(zhì)水。
(4)電解液中存在的硫酸根離子和氫離子在電力場(chǎng)的作用下分別移向電池的正負(fù)極,在電池內(nèi)部形成電流,整個(gè)回路形成,蓄電池向外持續(xù)放電。
(5)放電時(shí)H2SO4濃度不斷下降,正負(fù)極上的硫酸鉛(PbSO4)增加,電池內(nèi)阻增大(硫酸鉛不導(dǎo)電),電解液濃度下降,電池電動(dòng)勢(shì)降低。
(6)化學(xué)反應(yīng)式為:
鉛酸蓄電池充電過程的電化反應(yīng)
(1)充電時(shí),應(yīng)在外接一直流電源(充電極或整流器),使正、負(fù)極板在放電后天生的物質(zhì)恢復(fù)成原來的活性物質(zhì),并把外界的電能轉(zhuǎn)變?yōu)榛瘜W(xué)能儲(chǔ)存起來。
(2)在正極板上,在外界電流的作用下,硫酸鉛被離解為二價(jià)鉛離子(Pb2)和硫酸根負(fù)離子(SO4-2)由于外電源不斷從正極吸取電子,則正極板四周游離的二價(jià)鉛離子(Pb2)不斷放出兩個(gè)電子來補(bǔ)充,變成四價(jià)鉛離子(Pb4),并與水繼續(xù)反應(yīng),終極在正極極板上天生二氧化鉛(PbO2)。
(3)在負(fù)極板上,在外界電流的作用下,硫酸鉛被離解為二價(jià)鉛離子(Pb2)和硫酸根負(fù)離子(SO4 ̄2),由于負(fù)極不斷從外電源獲得電子,則負(fù)極板四周游離的二價(jià)鉛離子(Pb2)被中和為鉛(Pb),并以絨狀鉛附在負(fù)極板上。
(4)電解液中,正極不斷產(chǎn)生游離的氫離子(H)和硫酸根離子(SO4 ̄2),負(fù)極不斷產(chǎn)生硫酸根離子(SO4 ̄2),在電場(chǎng)的作用下,氫離子向負(fù)極移動(dòng),硫酸根離子向正極移動(dòng),形成電流。
(5)充電后期,在外電流的作用下,溶液中還會(huì)發(fā)生水的電解反應(yīng)。
(6)化學(xué)反應(yīng)式為:
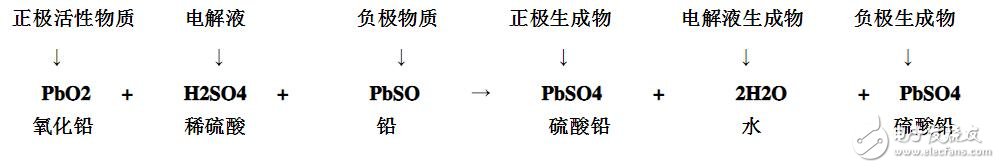
鉛酸蓄電池充放電后電解液的變化
(1)從上面可以看出,鉛蓄電池放電時(shí),電解液中的硫酸不斷減少,水逐漸增多,溶液比重下降。
(2)從上面可以看出,鉛酸蓄電池充電時(shí),電解液中的硫酸不斷增多,水逐漸減少,溶液比重上升。
(3)實(shí)際工作中,可以根據(jù)電解液比重的變化來判定鉛酸蓄電池的充電程度。(理士電池)
