研 究 背 景
水系鋅錳電池,由于其材料成本低,制備工藝簡單,容量高較高等優勢,被認為是具有潛力的水系儲能體系。然而,在放電過程中質子嵌入反應(二)生成的MnOOH容易發生歧化反應(反應一),造成陰極材料的溶解,導致循環性能不佳。此外,水分解限制了常規水系電解質的電壓窗口,從而限制能量密度的提高。鑒于此,很難同時提高循環穩定性和能量密度。
文 章 簡 介
基于此,中國科學技術大學錢逸泰教授&侯之國副教授團隊提出一種競爭反應機制原位調控質子嵌入反應,減少MnOOH生成,減少錳溶解。具體來說,通過耦合高交聯密度的水凝膠電解質,在弱酸性電解質中實現MnO2/Mn2+兩電子反應(反應三)的可逆充放電。
在放電過程中,反應二和三存在競爭關系,由于MnO2/Mn2+反應放電電壓高,并且消耗大量質子,質子嵌入反應被抑制,從而歧化反應造成的錳溶解得到限制,電池循環穩定性得到提高。于此同時,MnO2/Mn2+反應的引入,顯著提高了體系的能量密度。最終,鋅錳電池實現了858 Wh/kg基于α-MnO2的質量的高能量密度以及7000圈的長循環。
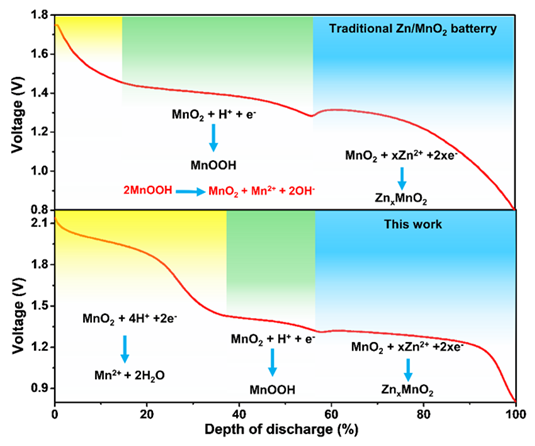
圖1. 競爭反應機理示意圖。
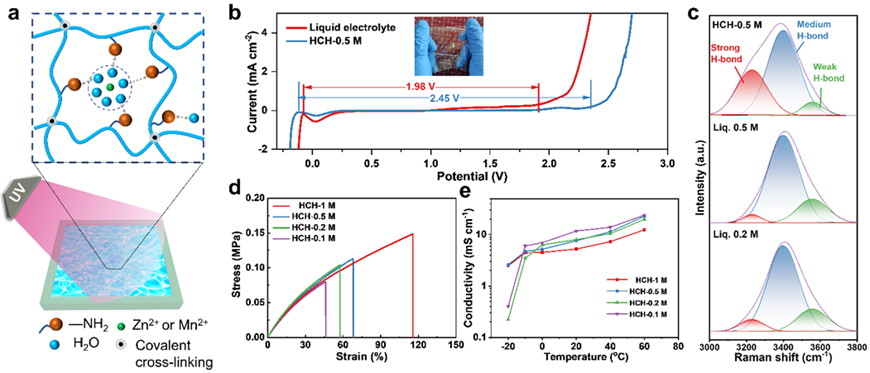
圖2. 高交聯密度水凝膠電解質的制備與表征。
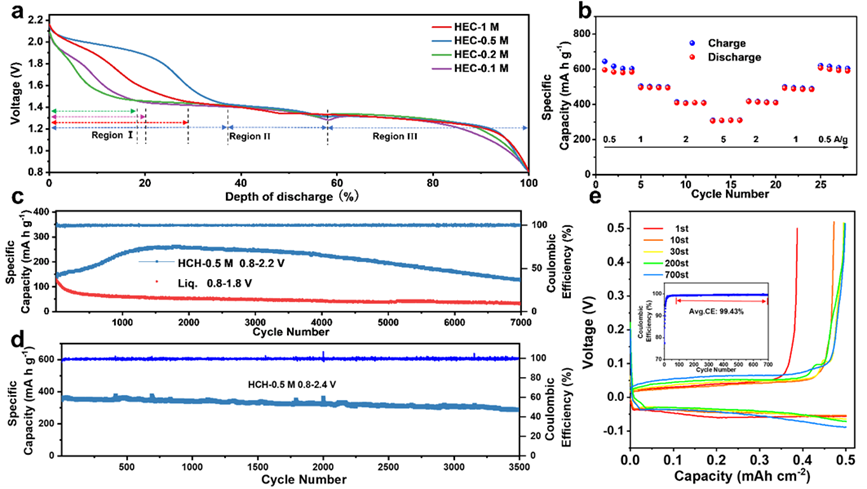
圖3. 基于HCH的鋅錳電池的電化學性能。
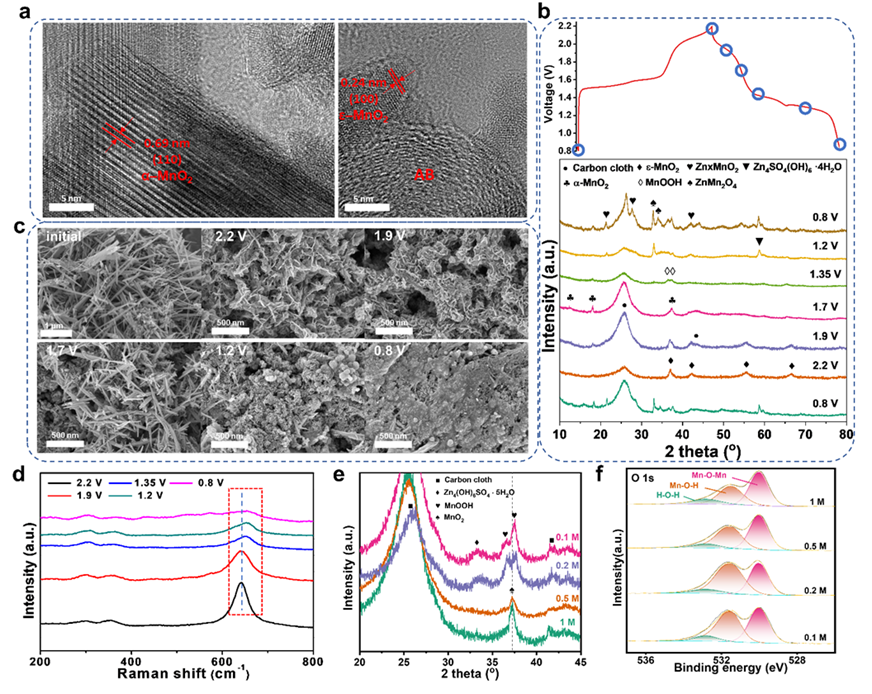
圖4. 電極反應機理表征。
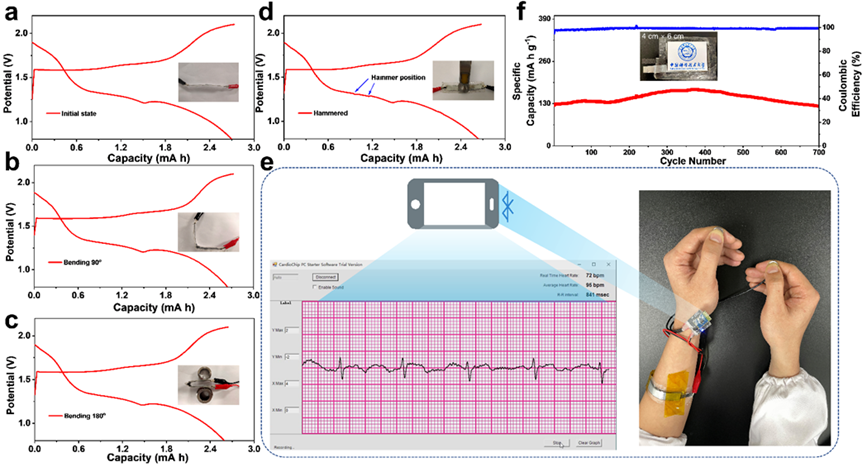
圖5. 不同工況下的HCH基柔性鋅錳電池性能。
本 文 要 點
要點一:陰極競爭反應機制
本文提出一種基于MnO2沉積溶解反應和質子嵌入反應的競爭反應機制,放電過程中,MnO2沉積溶解反應與質子嵌入反應競爭消耗質子。放電過程中,由于MnO2沉積溶解反應優先發生,質子嵌入反應得到極大的抑制,從而減少MnOOH的生成,進而降低由MnOOH歧化反應造成的錳溶解。
要點二:高交聯密度水凝膠電解質
一種超薄(101μm)的高交聯密度的水凝膠電解質(HCH)被制備。通過降低自由水含量,HCH的電壓窗口拓寬至2.45 V。HCH中大量的親水官能團和金屬陽離子與水分子相互作用,破壞了水分子形成的氫鍵網絡,從而限制質子從陰極遷移至陽極,保護陽極不受腐蝕的同時為MnO2/Mn2+維持酸性環境。
要點三:循環穩定性和能量密度同時提高
MnO2||HCH||Zn全電池經過7000次循環后,在0.8 ~ 2.2 V電壓范圍內的容量保持率為93.5%,以陰極質量為基準的能量密度為858 Wh/kg。實現能量密度和循環壽命同時提高。
審核編輯:劉清
