《麻省理工科技評(píng)論》從2001年開始,每年都會(huì)公布“10大突破技術(shù)”,即TR10(Technology Review 10),并預(yù)測(cè)其大規(guī)模商業(yè)化的潛力,以及對(duì)人類生活和社會(huì)的重大影響。
這些技術(shù)代表了當(dāng)前世界科技的發(fā)展前沿和未來(lái)發(fā)展方向,集中反映了近年來(lái)世界科技發(fā)展的新特點(diǎn)和新趨勢(shì),將引領(lǐng)面向未來(lái)的研究方向。其中許多技術(shù)已經(jīng)走向市場(chǎng),主導(dǎo)著產(chǎn)業(yè)技術(shù)的發(fā)展,極大地推動(dòng)了經(jīng)濟(jì)社會(huì)發(fā)展和科技創(chuàng)新。
正如《麻省理工科技評(píng)論》主編JasonPontin所說(shuō),突破性技術(shù)的定義非常簡(jiǎn)單,那就是能夠給人們帶來(lái)高質(zhì)量運(yùn)用科技的解決方案。有些技術(shù)是工程師們天才創(chuàng)意的結(jié)晶;而有的則是科學(xué)家們對(duì)長(zhǎng)期困擾他們的問(wèn)題所采取的諸多嘗試的集大成者(比如深度學(xué)習(xí))。評(píng)選“10大突破技術(shù)”的目的不僅僅是向人們展示新創(chuàng)新成果,同時(shí)也是為了強(qiáng)調(diào)是人類的聰明才智促生了這些創(chuàng)新技術(shù)。
因此動(dòng)脈網(wǎng)將為你篩選從2012年~2016年的醫(yī)學(xué)領(lǐng)域的科技突破。由于技術(shù)更迭快,因此只梳理最近5年之內(nèi)的。鑒于文章篇幅太長(zhǎng),將分為上下兩篇,每篇介紹七種技術(shù)。本文為上篇。這些技術(shù)是為解決問(wèn)題而生,將會(huì)極大地?cái)U(kuò)展人類的潛能,也有可能改變世界的面貌,值得在未來(lái)給予特別關(guān)注。
1.納米孔測(cè)序(2012)
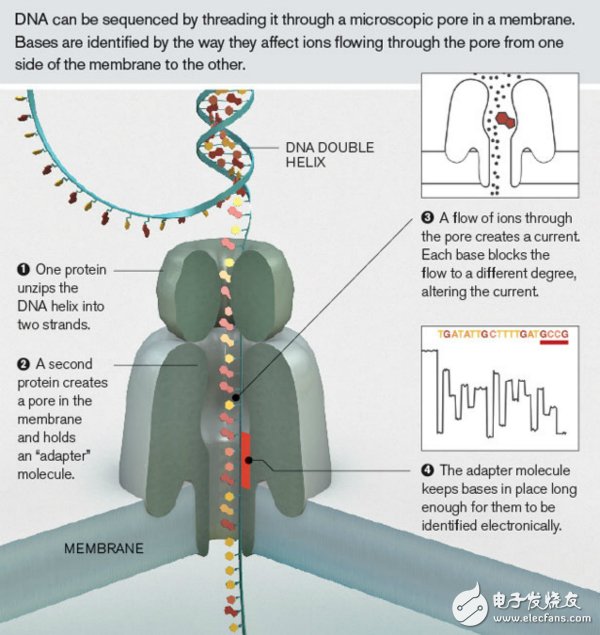
納米孔測(cè)序的流程圖
它能讀取較長(zhǎng)的基因片段,這有助于理解基因組的復(fù)雜區(qū)域
成熟期:至少10年后
突破點(diǎn):將單鏈DNA拉過(guò)蛋白孔,檢測(cè)堿基穿過(guò)時(shí)電導(dǎo)的微小改變
重要性:基因組測(cè)序更快,更便宜,更方便,開啟個(gè)性醫(yī)療時(shí)代
該領(lǐng)域主要參與者:Oxford Nanopore
縱觀測(cè)序技術(shù)的發(fā)展歷程,沒(méi)有哪一個(gè)技術(shù)像納米孔測(cè)序那樣慢熱。1996年哈佛大學(xué)的Daniel Branton、加州大學(xué)的David Deamer及其同事,在美國(guó)國(guó)家科學(xué)院院刊PNAS雜志上首次發(fā)表文章指出,可以用膜通道檢測(cè)多核苷酸序列。利用納米孔進(jìn)行測(cè)序的理念是非常直觀的:讓DNA堿基一個(gè)個(gè)穿過(guò)納米孔,同時(shí)快速鑒定每一個(gè)堿基。和其他DNA測(cè)序方法相比,它不需要使用熒光試劑來(lái)鑒定堿基或敲除DNA分子或者擴(kuò)增片段,能快速發(fā)現(xiàn)基因易位等情況。
2005年,Bayley、Gordon Sanghera和Spike Wilcocks創(chuàng)立的Oxford Nanopore公司,驗(yàn)證了納米孔測(cè)序的商業(yè)能力。 該技術(shù)提供了一種方法,使基因組測(cè)序更快,更便宜,并且足夠方便,讓醫(yī)生作為最常規(guī)的測(cè)序方法,開創(chuàng)了個(gè)性化醫(yī)學(xué)的時(shí)代,不過(guò)準(zhǔn)確率方面還有待提高。
尤其是2012年,Oxford Nanopore 公司推出了一種掌上納米孔測(cè)序儀MinION,方便攜帶也很便宜。它能讀取較長(zhǎng)的基因片段,這個(gè)平臺(tái)的平均讀長(zhǎng)大約在5kb左右,最長(zhǎng)能達(dá)到20kb,這有助于理解基因組的復(fù)雜區(qū)域。MinION還可以插入筆記本電腦的USB接口,在屏幕上顯示數(shù)據(jù)生成的過(guò)程。最近發(fā)表的研究顯示MinION相當(dāng)實(shí)用,能準(zhǔn)確測(cè)序小基因組(比如細(xì)菌和酵母基因組),區(qū)分親緣關(guān)系很近的細(xì)菌和病毒,讀取人類基因組的復(fù)雜區(qū)域等。
今年,哥倫比亞大學(xué)的車靖岳(Jingyue Ju)和哈佛大學(xué)的George Church教授合作開發(fā)了基于納米孔的單分子邊合成邊測(cè)序(SBS)系統(tǒng),對(duì)這一測(cè)序技術(shù)進(jìn)行升級(jí),打造了高通量的單分子納米孔測(cè)序平臺(tái)。但目前科學(xué)家正在通過(guò)減緩DNA序列通過(guò)納米孔速度的方式提高此項(xiàng)測(cè)序的準(zhǔn)確度,畢竟目前來(lái)看,該技術(shù)尚不成熟。
2.卵原干細(xì)胞(2012)
哈佛大學(xué)生殖生物學(xué)家喬納森·蒂利
人類也有一種類似老鼠等動(dòng)物的卵原干細(xì)胞,或可成為無(wú)盡的卵子來(lái)源
成熟期:受質(zhì)疑
突破點(diǎn):精確細(xì)胞分選技術(shù),從成人卵巢內(nèi)分離出了卵原干細(xì)胞
重要性:在實(shí)驗(yàn)室中大量培育卵原干細(xì)胞,治療女性不孕不育,甚至延遲卵巢早衰
該領(lǐng)域主要參與者:馬薩諸塞總醫(yī)院、OvaScience、Jonathan Tilly
哈佛大學(xué)生殖生物學(xué)家喬納森·蒂利(Jonathan Tilly,同時(shí)在馬薩諸塞總醫(yī)院指導(dǎo)了一個(gè)生殖生物學(xué)中心)研究團(tuán)隊(duì),證明了人類也有一種類似老鼠等動(dòng)物的卵原干細(xì)胞,或可成為無(wú)盡的卵子來(lái)源。因?yàn)閷?duì)于一個(gè)女性來(lái)說(shuō),到了40歲之后,卵子的數(shù)量和質(zhì)量就會(huì)下降,“卵原干細(xì)胞”的發(fā)現(xiàn)有望為治療女性不孕不育,甚至延遲卵巢早衰提供新方法。
這些卵原干細(xì)胞來(lái)自于成年女性的卵巢,說(shuō)明女性成年后仍然有可能形成新的卵子。如果能在實(shí)驗(yàn)室中大量培育這種卵原干細(xì)胞,也意味著醫(yī)療上擁有了無(wú)盡的卵子來(lái)源。這一發(fā)現(xiàn)對(duì)女性卵子數(shù)量在出生時(shí)就已被限定的傳統(tǒng)觀點(diǎn)形成挑戰(zhàn)。
蒂利團(tuán)隊(duì)曾在2004年首次證明,雌性老鼠在進(jìn)入成年后還能持續(xù)制造出卵母細(xì)胞。后來(lái)蒂利團(tuán)隊(duì)研發(fā)出一個(gè)更加精確的細(xì)胞分選技術(shù),并使用該技術(shù)從成人卵巢內(nèi)分離出了卵原干細(xì)胞,得到的細(xì)胞像老鼠卵原干細(xì)胞一樣,能自發(fā)形成具有卵母細(xì)胞特征的細(xì)胞,這些卵母細(xì)胞擁有人類卵巢內(nèi)卵母細(xì)胞的物理外表和遺傳表達(dá)模式。
蒂利表示,研究有望用于建立人類卵原干細(xì)胞庫(kù),最關(guān)鍵的是可能找到方法讓卵原干細(xì)胞在試管受精中發(fā)育成成熟的人類卵母細(xì)胞,以改進(jìn)試管受精的結(jié)果,并為不孕不育癥提供新療法。不過(guò)截止到目前,卵原干細(xì)胞仍然受到質(zhì)疑,也并沒(méi)有通過(guò)卵原干細(xì)胞培育成任何新生兒。
總部位于波士頓的OvaScience正在將蒂利的工作商業(yè)化。該公司的聯(lián)合創(chuàng)始人包括風(fēng)險(xiǎn)投資家Christoph Westphal和哈佛大學(xué)抗衰老研究員David Sinclair,他們創(chuàng)立了Sirtris Pharmaceuticals公司,并于2008年以7.2億美元的價(jià)格出售給GlaxoSmithKline。OvaScience在2012年就募集了4300萬(wàn)美元,用于追求干細(xì)胞的生育治療和其他應(yīng)用,目前公司運(yùn)營(yíng)良好。
3.記憶移植(2013)
記憶移植,目前仍然受到很多質(zhì)疑
不太遠(yuǎn)的一天,當(dāng)嚴(yán)重記憶喪失的病人可以從電子植入物獲得幫助
成熟期:尚不成熟
突破點(diǎn):使用記憶數(shù)據(jù),信號(hào)被硅芯片轉(zhuǎn)換成為一個(gè)長(zhǎng)期記憶的方式
重要性:為長(zhǎng)期記憶缺失患者做修復(fù)性的移植
該領(lǐng)域主要參與者:Theodore Berger
這個(gè)想法是如此大膽,所以遠(yuǎn)在神經(jīng)科學(xué)的主流之外,西奧多·伯格(Theodore Berger)是這個(gè)行業(yè)有遠(yuǎn)見的先驅(qū)者的角色。他是南加州大學(xué)洛杉磯分校的生物醫(yī)學(xué)工程師和神經(jīng)科學(xué)家,他設(shè)想在不太遠(yuǎn)的一天,當(dāng)嚴(yán)重記憶喪失的病人可以從電子植入物獲得幫助。
對(duì)大腦遭受阿爾茨海默病,中風(fēng)或損傷的人中,破壞的神經(jīng)元網(wǎng)絡(luò)通常防止長(zhǎng)期記憶形成。二十多年來(lái),Berger設(shè)計(jì)了硅芯片,以模擬這些神經(jīng)元在正常工作時(shí)所做的信號(hào)處理,這項(xiàng)工作允許我們?cè)谝环昼娭畠?nèi)記住經(jīng)驗(yàn)和知識(shí)。最終,Berger想要通過(guò)在大腦中植入這樣的芯片來(lái)恢復(fù)創(chuàng)造長(zhǎng)期記憶的能力。
Berger通過(guò)電極與老鼠和猴子大腦外部連接的硅芯片研究處理像實(shí)際神經(jīng)元的信息,并且在神經(jīng)假體手術(shù)中取得成功。耳蝸植入物幫助了超過(guò)200,000聾人通過(guò)將聲音轉(zhuǎn)換為電信號(hào),并將其發(fā)送到聽覺(jué)神經(jīng)而聽到。其他研究人員在盲人的人工視網(wǎng)膜方面取得了初步成功。
Berger還與USC的生物醫(yī)學(xué)工程師Vasilis Marmarelis合作,開始制造腦假體。 他們首先使用來(lái)自老鼠的海馬回切片。知道神經(jīng)元信號(hào)從海馬的一端移動(dòng)到另一端,研究人員發(fā)送隨機(jī)脈沖到海馬回,記錄在各種地點(diǎn)的信號(hào),看看它們是如何變換,然后導(dǎo)出描述變換的數(shù)學(xué)方程,并且他們?cè)谟?jì)算機(jī)芯片中實(shí)現(xiàn)了這些方程。使用這些數(shù)據(jù),Berger和他的團(tuán)隊(duì)建模了信號(hào)被轉(zhuǎn)換成為一個(gè)長(zhǎng)期記憶的方式。
盡管有不確定性,Berger和他的同事一直在規(guī)劃人類研究。 他還與他的大學(xué)的臨床醫(yī)生合作,測(cè)試使用植入海馬回每側(cè)的電極來(lái)檢測(cè)和預(yù)防嚴(yán)重癲癇患者的癲癇發(fā)作,甚至幫助這些患者在大腦中尋找記憶。
4.產(chǎn)前DNA 測(cè)序(2013)
產(chǎn)前DNA檢測(cè)已經(jīng)發(fā)展到無(wú)創(chuàng)產(chǎn)前基因檢測(cè)(NIPT)階段
目前已經(jīng)可以通過(guò)母體外周血提取胎兒游離 DNA(cffDNA),進(jìn)行篩查疾病
成熟期:已成熟
突破點(diǎn):通過(guò)一小管母親血液中的胎兒DNA對(duì)基因測(cè)序
重要性:在胎兒出生前進(jìn)行基因檢測(cè),排除多種基因缺陷病
該領(lǐng)域主要參與者:Illumina、Verinata、Sequenom、Natera、Ariosa、LifeCodexx、盧煜明
提到產(chǎn)前DNA測(cè)序就不能不說(shuō)Illumina和Verinata。2013年1月7號(hào),Illumina——這家世界上最廣泛使用的DNA測(cè)序儀的生產(chǎn)商以3.5億美元收購(gòu)了Verinata公司。而Verinata不過(guò)是一家?guī)缀踹€沒(méi)有收入的創(chuàng)業(yè)公司。吸引Illumina的是Verinata的先進(jìn)技術(shù):對(duì)未出生胎兒進(jìn)行DNA測(cè)序。這項(xiàng)技術(shù)可以通過(guò)一小管母親血液中的胎兒DNA而檢測(cè)唐氏綜合癥。在以前,唐氏綜合癥檢測(cè)意味著要從胎盤或羊水中獲取胎兒的細(xì)胞,這些方式都具有一定的流產(chǎn)風(fēng)險(xiǎn)。
利用母親的血液可以獲取胎兒基因組信息,一些患者為了了解自己的遺傳性疾病或諸如癌癥等疾病而接受基因組測(cè)序,但是將來(lái)人類無(wú)需等到發(fā)病了才去做測(cè)序,在出生時(shí)就知道相關(guān)的信息。根據(jù)中國(guó)香港科學(xué)家盧煜明的研究,母親血液中游離的DNA中有15%是來(lái)自于胎兒。
通過(guò)快速的DNA測(cè)序技術(shù),這些片段可以轉(zhuǎn)變?yōu)榇罅康男畔ⅲ贿^(guò)后來(lái),Verinata的創(chuàng)始人、斯坦福大學(xué)生物物理學(xué)家Stephen Quake很快發(fā)現(xiàn),利用母親血液中的胎兒DNA除了可以篩查染色體異常外,還可以對(duì)胎兒進(jìn)行全基因組測(cè)序,這樣就可以在胎兒出生前排除患有囊性纖維化(cystic fibrosis)、β-地中海貧血癥以及自閉癥等風(fēng)險(xiǎn)。而且這項(xiàng)基因檢測(cè)成本一直在下降。
目前,已經(jīng)發(fā)展到無(wú)創(chuàng)產(chǎn)前基因檢測(cè)(NIPT)階段,這項(xiàng)技術(shù)是通過(guò)母體外周血提取胎兒游離 DNA(cffDNA),進(jìn)行篩查如唐氏綜合征,Rh血型,性染色體異常,以及胎兒性別,是測(cè)序中競(jìng)爭(zhēng)最為激烈的領(lǐng)域。無(wú)創(chuàng)產(chǎn)前基因檢測(cè)在全球,尤其是在低收入和中等收入國(guó)家逐漸普及。不過(guò)產(chǎn)前檢測(cè)讓醫(yī)生面臨的法律與道德義務(wù)變得更加復(fù)雜,近日衛(wèi)計(jì)委發(fā)布了通知,無(wú)創(chuàng)產(chǎn)前篩查和診斷試點(diǎn)正式取消,篩查機(jī)構(gòu)必須獲得新的職業(yè)許可證書。成人可以決定是否對(duì)自己的基因組進(jìn)行測(cè)序,而未出生的胎兒是不能對(duì)此表示意見的。這些信息可能會(huì)影響人的一生。甚至有人提出提供檢測(cè)的服務(wù)商,應(yīng)該將其報(bào)告限制在20種左右最常見的嚴(yán)重疾病中。
5.深度學(xué)習(xí)(2013)
深度學(xué)習(xí)技術(shù)推動(dòng)人工智能向前發(fā)展的核心力量
為醫(yī)生提供可供選擇的循證治療方案,已經(jīng)實(shí)現(xiàn)幫助醫(yī)生做出更好的決策
成熟期:正在使用
突破點(diǎn):神經(jīng)網(wǎng)絡(luò)深度學(xué)習(xí)算法,使神經(jīng)網(wǎng)絡(luò)的能力大大提高
重要性:試圖模擬大腦的工作方式,提高醫(yī)療效率,尤其在腫瘤治療領(lǐng)域力圖實(shí)現(xiàn)精準(zhǔn)治療
該領(lǐng)域主要參與者:谷歌、谷歌、蘋果、IBM、微軟、Facebook、百度等
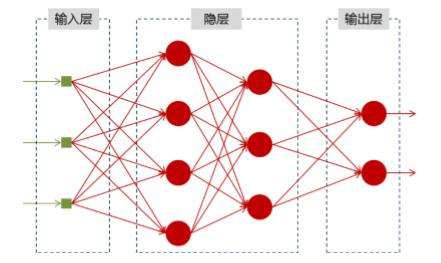
深度學(xué)習(xí)是和人工智能的發(fā)展深度結(jié)合在一起的。其實(shí),深度學(xué)習(xí)并不是新生事物,它是傳統(tǒng)神經(jīng)網(wǎng)絡(luò)(Neural Network)的發(fā)展。神經(jīng)網(wǎng)絡(luò)研究領(lǐng)域的領(lǐng)軍者Hinton在2006年提出了神經(jīng)網(wǎng)絡(luò)深度學(xué)習(xí)算法,使神經(jīng)網(wǎng)絡(luò)的能力大大提高,向支持向量機(jī)發(fā)出挑戰(zhàn)。Hinton和他的學(xué)生Salakhutdinov在頂尖學(xué)術(shù)刊物《Scince》上發(fā)表了一篇文章,開啟了深度學(xué)習(xí)的篇章。
深度學(xué)習(xí)的核心就是算法,算法模型也經(jīng)歷了一個(gè)快速迭代的周期,Deep Belief Network、Sparse Coding、Recursive Neural Network, Convolutional Neural Network等各種新的算法模型被不斷提出,而其中卷積神經(jīng)網(wǎng)絡(luò)(Convolutional Neural Network,CNN)更是成為圖像識(shí)別最炙手可熱的算法模型。目前已經(jīng)在語(yǔ)音識(shí)別、圖像識(shí)別等應(yīng)用非常廣泛。
在醫(yī)學(xué)領(lǐng)域,以深度學(xué)習(xí)為基礎(chǔ)的人工智能,從學(xué)習(xí)在豐富的醫(yī)學(xué)數(shù)據(jù)中識(shí)別復(fù)雜模式的算法,到為個(gè)性化醫(yī)療提供對(duì)現(xiàn)實(shí)世界證據(jù)的分析,再到發(fā)現(xiàn)與 DNA 結(jié)合的蛋白質(zhì)的序列特異性和怎樣用其協(xié)助基因組診斷以及個(gè)性化治療,在醫(yī)學(xué)成像上可提高分辨率、分析的廣度和速度以及診斷上帶來(lái)了非常了不起的進(jìn)步,甚至在藥物開發(fā)和更廣泛的治療干預(yù)上顯示出了巨大的潛力。
尤其是谷歌,已經(jīng)成了吸引深度學(xué)習(xí)和人工智能人才的磁鐵。2013 年 3 月,谷歌收購(gòu)了一家創(chuàng)業(yè)企業(yè),它的創(chuàng)始人是多倫多大學(xué)的計(jì)算機(jī)科學(xué)教授杰弗里·辛頓——是贏得默克比賽的團(tuán)隊(duì)成員。辛頓會(huì)同時(shí)兼顧大學(xué)和谷歌的工作,他說(shuō)計(jì)劃“在這一領(lǐng)域中提出構(gòu)想,然后把它們用在真正的問(wèn)題上“,這些問(wèn)題包括圖像識(shí)別、搜索,和自然語(yǔ)言理解。
2012年6月,谷歌展示了當(dāng)時(shí)最大的神經(jīng)網(wǎng)絡(luò)之一,其中擁有超過(guò)10億個(gè)連接。由斯坦福大學(xué)計(jì)算機(jī)科學(xué)教授吳恩達(dá)和谷歌研究員杰夫·迪安帶領(lǐng)的團(tuán)隊(duì),給系統(tǒng)展示了一千萬(wàn)張從YouTubu視頻中隨機(jī)選擇的圖片。軟件模型中的一個(gè)模擬神經(jīng)元專門識(shí)別貓的圖像,其他專注于人臉、黃色的花朵,以及其他物體。由于深度學(xué)習(xí)的能力,即使沒(méi)人曾經(jīng)定義或標(biāo)記過(guò),系統(tǒng)也識(shí)別了這些獨(dú)立的對(duì)象。IBM的沃森在腫瘤精準(zhǔn)治療領(lǐng)域,能夠在幾秒之內(nèi)篩選數(shù)十年癌癥治療歷史中的150萬(wàn)份患者記錄,包括病歷和患者治療結(jié)果,并為醫(yī)生提供可供選擇的循證治療方案,已經(jīng)實(shí)現(xiàn)幫助醫(yī)生做出更好的決策。
在2011年到2015年的五年時(shí)間,人工智能領(lǐng)域的并購(gòu)資金從2.82億美元增長(zhǎng)到2015年的23.88億美元,而并購(gòu)數(shù)量也從67起增長(zhǎng)到397起。以谷歌、蘋果、IBM、微軟、Facebook為代表的等行業(yè)巨頭正在通過(guò)并購(gòu)進(jìn)行產(chǎn)業(yè)布局。
6.基因組編輯(2014)
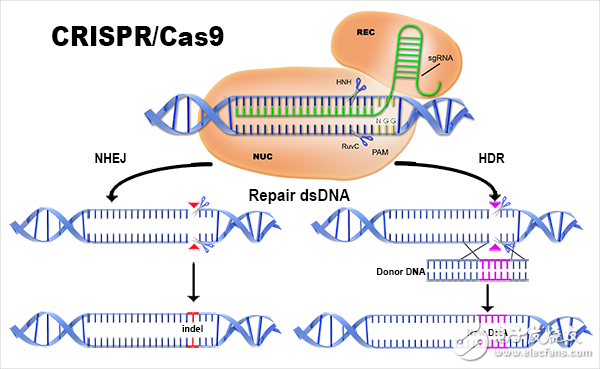
CRISPR的工作流程,創(chuàng)新性地利用RNA
通過(guò)基因編輯攜帶定向突變的靈長(zhǎng)類動(dòng)物的能力,為科學(xué)家研究與遺傳相關(guān)的疾病提供方法
成熟期:進(jìn)入到診斷
突破點(diǎn): 利用基因組工具構(gòu)建出兩只攜帶有特定基因突變的猴子
重要性:為人類疾病研究提供了新的有價(jià)值的工具
該領(lǐng)域主要參與者:云南省靈長(zhǎng)類生物醫(yī)學(xué)重點(diǎn)實(shí)驗(yàn)室,Jennifer Doudna(加州大學(xué)伯克利分校),張峰(麻省理工學(xué)院),George Church(哈佛大學(xué))
科學(xué)家們認(rèn)為,CRISPR可能是自20世紀(jì)70年代生物技術(shù)時(shí)代開啟以來(lái)出現(xiàn)的最重要的基因工程技術(shù)。CRISPR系統(tǒng)具有搜索和替換DNA的雙重功能,可以讓科學(xué)們通過(guò)替換堿基,輕松的改變DNA的功能。目前已經(jīng)證實(shí),利用CRISPR可以治療小鼠的肌肉萎縮、罕見肝臟疾病,使人類細(xì)胞免疫HIV等驚人的功能。在資本市場(chǎng)上,都是千萬(wàn)美元級(jí)別的投資。Emmanuelle Charpentier在歐洲創(chuàng)立了CRISPR Therapeutics。Jennifer Doudna之前與張鋒共同創(chuàng)立了Editas Medicine,離開Editas Medicine后她現(xiàn)在創(chuàng)立了一家小公司Caribou Biosciences。
CRISPR/Cas是在大多數(shù)細(xì)菌和古細(xì)菌中發(fā)現(xiàn)的一種天然免疫系統(tǒng),可用來(lái)對(duì)抗入侵的病毒及外源DNA。最先試驗(yàn)的是一對(duì)出生在昆明科靈生物科技有限公司(Kunming Biomedical International)和云南靈長(zhǎng)類動(dòng)物生物醫(yī)學(xué)研究重點(diǎn)實(shí)驗(yàn)室里雌性雙胞胎恒河猴明明和玲玲。在體外受精后,科學(xué)家用了新型DNA工程技術(shù)CRISPR在受精卵中編輯修改了3個(gè)基因。標(biāo)志著CRISPR可以在靈長(zhǎng)動(dòng)物體內(nèi)完成靶向遺傳修飾。在過(guò)去幾年,CRISPR由加州大學(xué)伯克利分校、哈佛大學(xué)、麻省理工學(xué)院等機(jī)構(gòu)的研究人員研發(fā)出來(lái)。這項(xiàng)技術(shù)已經(jīng)開始轉(zhuǎn)變科學(xué)家對(duì)遺傳工程的理解,因?yàn)樗梢宰屗麄兙_并相對(duì)輕松地改變基因組。
CRISPR可以精確并相對(duì)容易地,在染色體上的某個(gè)特定部位改變DNA,理論上,這項(xiàng)技術(shù)可以在培養(yǎng)皿中改變?nèi)魏蝿?dòng)物細(xì)胞類型的基因,包括人類細(xì)胞。CRISPR與早期的基因組編輯方法:鋅指核酸酶(ZFN)以及轉(zhuǎn)錄激活因子樣效應(yīng)物核酸酶(TALEN)系統(tǒng)相似。但是后兩種方法都是利用蛋 白質(zhì)來(lái)定位靶序列,這些蛋白質(zhì)通常很難生成且成本高昂。CRISPR利用的是RNA,使得設(shè)計(jì)它們變得較為容易。
某個(gè)基因變異的重要性通常并不明確,它很可能會(huì)致病,也可能僅僅和某種疾病間接相關(guān),CRISPR可以幫助研究人員找到確實(shí)能致病的突變。在究竟誰(shuí)該擁有CRISPR專利問(wèn)題上,雖然還有爭(zhēng)議,人們普遍認(rèn)為是Charpentier和Doudna推動(dòng)了CRISPR編輯的發(fā)展,張峰則是通過(guò)證實(shí)它能夠在真核細(xì)胞中起作用揭示了它的巨大潛力,來(lái)自哈佛醫(yī)學(xué)院的George Church獨(dú)立證實(shí)了張鋒的這一研究發(fā)現(xiàn)。
CRISPR未來(lái)最有潛力的應(yīng)用是,修復(fù)人類組織中的基因,可以治療諸如血友病、罕見代謝疾病、亨廷頓氏病和精神分裂癥等基因疾病。隨著對(duì)CRISPR系統(tǒng)認(rèn)識(shí)的加深,實(shí)驗(yàn)設(shè)計(jì)的優(yōu)化改造,相信其靶向效率會(huì)進(jìn)一步提高,CRISPR以及其衍生技術(shù)終究會(huì)帶來(lái)一場(chǎng)科學(xué)史上的巨大變革。
7.大腦成像圖(2014)
清晰的大腦成像圖讓神經(jīng)科學(xué)家更完整深入地觀察大腦結(jié)構(gòu)
極為精細(xì)的大腦成像圖,第一次在細(xì)胞水平上剖析了人類大腦,為神經(jīng)科學(xué)家提供了解讀其無(wú)窮復(fù)雜性的指南
成熟期:尚未完全成熟
突破點(diǎn):高分辨率,以20微米的尺度展現(xiàn)了人類大腦的結(jié)構(gòu)
重要性:能夠讓神經(jīng)科學(xué)家更完整深入地觀察大腦結(jié)構(gòu),了解大腦不同區(qū)域之間的相互作用,腦結(jié)構(gòu)及其對(duì)人行為的控制
該領(lǐng)域主要參與者:Katrin Amunts(德國(guó)尤利希研究中心),Alan Evans(蒙特利爾神經(jīng)學(xué)研究所),Karl Deisseroth(斯坦福大學(xué))、圣路易斯華盛頓大學(xué)
人腦一直是個(gè)神秘地帶,人類也一直試圖了解人腦的全部,“歐洲人腦計(jì)劃”(提出在巨型計(jì)算機(jī)上對(duì)人腦建模)、“美國(guó)腦計(jì)劃”(要從多個(gè)維度獲取大腦活動(dòng)數(shù)據(jù)并對(duì)此建模)這些雄心勃勃的計(jì)劃,都在嘗試創(chuàng)建一個(gè)廣泛的大腦活動(dòng)的圖片。
大腦圖譜的早期工作應(yīng)該要?dú)w功于神經(jīng)解剖學(xué)家們,其中最有名的應(yīng)該是布魯?shù)侣↘orbinian Brodmann)在20世紀(jì)初的工作。在此之前,關(guān)于大腦的不同區(qū)域負(fù)責(zé)不同功能的觀點(diǎn)已經(jīng)隨著顱相學(xué)的流行而興起,在布洛卡(Broca)等腦區(qū)的功能而得到強(qiáng)化。然而,布魯?shù)侣P(guān)注于腦區(qū)的細(xì)胞構(gòu)筑,未從3D空間來(lái)建立大腦的模型。3D大腦模型的出現(xiàn),得益于法國(guó)神經(jīng)解剖學(xué)家Jean Talairach,他在于1967年提出一個(gè)3D的大腦模型,與Tounoux 于1988年進(jìn)一步完善此大腦模型。
目前最通用的模板,是加拿大蒙特利爾神經(jīng)研究所(Montreal Neurological Institute,MNI)于90年代表所建立的MNI系列模板。在最早的嘗試中,他們掃描了241個(gè)正常志愿者的大腦結(jié)構(gòu),按照Talairach大腦圖譜的方式,使用標(biāo)志性的大腦結(jié)構(gòu)對(duì)每個(gè)受試者的大腦進(jìn)行標(biāo)定,得到每個(gè)大腦的AC-PC線和大腦的外部輪廓。目前使用更為廣泛的是ICBM152模板,也是由MNI出品,然而MNI305和ICBM152模板中無(wú)法清楚地看到每個(gè)大腦的結(jié)構(gòu)。
在德國(guó)尤利希研究中心與MNI共同完成的“Bigbrain”項(xiàng)目中,建立了第一個(gè)細(xì)胞級(jí)別的超高分辨率的大腦3D模型:由7404個(gè)組織切片組成的,分辨率達(dá)到20微米,幾乎精確到了分子級(jí)別。這個(gè)花了十年的地圖集,在超級(jí)計(jì)算機(jī)的幫助下將它們數(shù)字化縫合在一起,超清晰3D大腦模型的建立,有望為今后神經(jīng)成像提供一個(gè)更加標(biāo)準(zhǔn)的大腦圖譜,也為今后建立標(biāo)準(zhǔn)3D大腦模型提供了新的途徑。
清晰的大腦成像圖得益于技術(shù)的創(chuàng)新,比如德國(guó)尤利希研究中心的Amunts正在開發(fā)一種這樣的技術(shù),使用偏振光來(lái)重建腦組織中的神經(jīng)纖維的三維結(jié)構(gòu)。在斯坦福大學(xué)的神經(jīng)科學(xué)家和生物工程師Karl Deisseroth的實(shí)驗(yàn)室開發(fā)了一種名為Clarity的技術(shù),允許科學(xué)家直接看到完整腦中神經(jīng)元和電路的結(jié)構(gòu)。今年7月,美國(guó)圣路易斯華盛頓大學(xué)的一個(gè)研究小組稱,他們繪制出迄今最全面、最精確的人類大腦圖譜,其中97個(gè)人類大腦皮層區(qū)域此前從未描述過(guò),屬于首次公布。
下篇:《麻省理工科技評(píng)論評(píng)選的14大醫(yī)療領(lǐng)域突破科技(下)》
 電子發(fā)燒友App
電子發(fā)燒友App






























評(píng)論